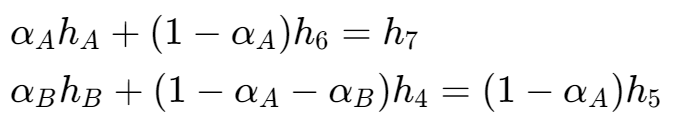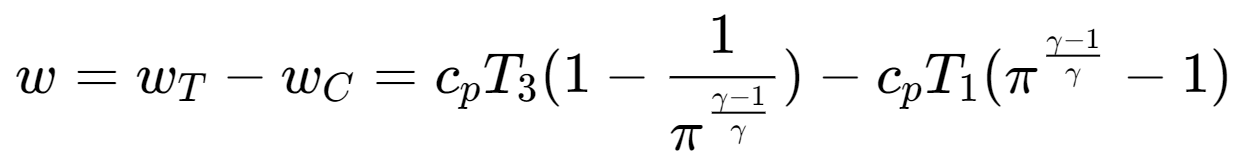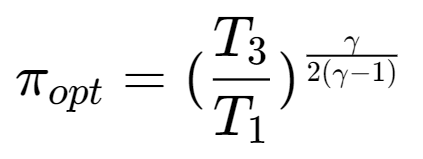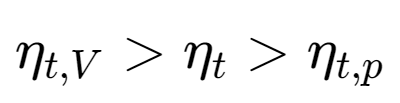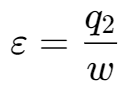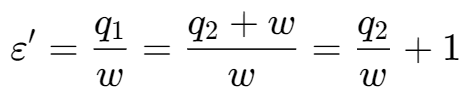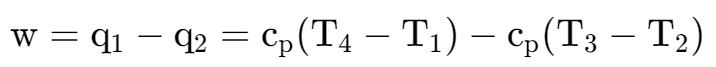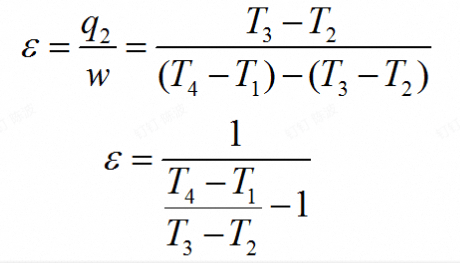绪论
研究的问题
热力学是研究有序能和无序能之间的相互转换(热与功)
能量在信息领域的应用:
$$ H(X)=-\Sigma ^n_{i=1}p_i\log_2 p_i $$相同的体积,薄片的表面积大,传热效率高,在此角度上,薄片小,优先使用
热力系
热力系的平衡
-
平衡的条件:
温差,力差消失,处于平衡状态的热力系有着均匀一致的温度(T),压力(P)
-
状态参数:
- 状态的单值函数
- 变化量与过程无关
- 原来平衡的系统经过一系列的封闭过程,状态参数的变化为0
- 状态参数的微分是全微分
热力学第0定理:
- 两个热力系都与第三个热力系平衡,则两个系统彼此之间也处于热平衡。
- 对于组成一定的闭系:用n+1的独立状态参数确定(n为准静功的数目,1为考虑与外界的热交换)
- 研究准平衡过程:活塞的移动非常缓慢,远大于弛豫时间(由不平衡到平衡的时间)
热力循环:
- $$ \epsilon=\frac{}{} $$
- $$ \epsilon=\frac{}{} $$
热力学
热力学第一定理
- 热力学中功的定义:对外界的作用可以用在外界举起重物的单一效果来代替
由状态1变化到状态2时的容积变化功
- 热:热力系与外界考温差传递能量称为热——是一个过程量,不是状态量
状态参数热力学能
$$ dU=\delta Q-\delta W $$- U为以一定方式储存于热力系内部的能量叫做系统的热力学能(亦称内能)
- 是一个状态参数,可以使用其他独立的状态参数表示
内能与温度有关,温度又会收到传热和做功的影响

内能包括气体的动能和分子之间的势能,及内位能和内动能
外部储存能
- $$ E_k=\frac{1}{2}mc_f^2 $$
-
宏观位能(重力位能)
质量守恒方程式
-
稳定流动:
流道内各点的流体的热力状态及流动情况不随时间变化
-
流入、流出的质量相等
流动功:
- 系统付诸于质量迁移所作的功(也可以叫做推挤功)
- 与宏观流动有关
- 仅仅发生位置变化
- 是状态量
- 并非工质本身能量的变化,而是由外界做出的能量
热力学第一定理的表达式
基本表达式
$$ Q=\Delta U +W $$- 适用于闭系内进行的一切过程
总储能
$$ E=U+E_k+E_p $$- 总能=热力学能(内部储存能)+宏观动能+重力位能(后两个为外部储存能)
开系的能量方程
- 进入系统的能量:
- 离开系统的能量: $$ \delta W_s+\delta m_2(u_2+p_2v_2+c_2^2/2+gz_2) $$ 作差得到的就是$dE_{ev}$,为系统能量的变化量。
- $\Delta h$为焓,$=\Delta u+pv$
- 对这个式子可以取单位工质和微元过程
技术功
-
对于上述式子(13)的$\frac{1}{2}\Delta c^2+g\Delta z+w_s$=$w_t$
-
$w_t$称为技术功(技术上可以直接利用来做功的能量)
对于可逆过程:
- $w_t=\int_1^2-vdp$
总结:
能量变化公式
| 公式 | 适用条件 |
|---|---|
| $Q=\Delta U +W$ | 适用于闭口系的任何工质、任何过程 |
| $q=\Delta u+\int_1^2pdv$ | 适用于闭口系的任何工质、可逆过程 |
| $Q=[\Delta h+\frac{1}{2}\Delta c^2+g\Delta z]m+W_s$ | 适用于稳定流动系统的任何工质、任何过程 |
| $q=\Delta h+w_t$ | 同上 |
| $q=\Delta h-\int _1^2vdp$ | 适用于稳定流动系统的任何工质、可逆过程 |
功的辨析:
| 名称 | 含义 | 说明 |
|---|---|---|
| 体积变化功$W$ | 系统体积变化所完成的功 | ①过程可逆时$W=\int_1^2pdV$ ②膨胀功往往是对应闭口系所求的功 ③是简单可压缩系热变功的来源 |
| 轴功$W_s$ | 系统通过轴与外界交换的功 | 是开口系所求的功 当工质的动、位能差被忽略时,等于技术功 |
| 流动功$W_f$ | 开口系付诸于质量迁移所做的功 | $=p_2V_2-p_1V_1$ |
| 技术功$W_t$ | 技术上可资利用的功 | 1.$W_t与W_s的关系:\frac{1}{2}\Delta c^2+g\Delta z+w_s$ 2.与$W,W_f的关系:W_t=W-W_f$ |
能量方程式的应用:
- 热力发动机
- 喷管
- 汽轮机叶轮
- 热交换器
- 压气机
- 节流过程
所以在稳定流动系统中,当系统的总能量不变时,系统功的变化有流动气体自身的内能、动能、位能的变化,气体流动的流动功,还有流动气体在轴上做的轴功。
技术功是系统在稳定流动过程中与外界交换的净机械功,它等于膨胀功减去流动功。这是因为:
- 膨胀功是系统内部能量的减少,即系统对外界所做的功。
- 流动功是系统在流动过程中从外界获得的功,即外界对系统所做的功。
热力学第二定理
反过来对热力学第二定律的理解
实际上就是熵增定律(孤立系统的熵永不减少,在可逆过程中熵不变,在不可逆过程中熵增加。)
比较原始的一种说法是总是向着混乱程度增加的方向进行(揭示了宇宙、时间发展的一种规律,非常本质),熵就是反应混乱程度的一种直接的物理量
什么是混乱呢?气体均匀分布比集中分布在某一区域混乱,气体的运动比固体的运动混乱,微观的气体运动又比宏观物体运动混乱。
熵有两个基本的公式:$S=k_B\ln\Omega$和$S=\frac{\delta Q}{T}$,前者是最为基本的,反映了熵是衡量系统的混乱程度,后者只有在可逆过程才是可以使用的(这里的可以过程是指缓慢的变化,之后学的一般认为是可逆的过程,比如热源缓慢地放热)
- 第一个公式,气体的混乱程度受到温度(影响气体分子的动能,或者说是内能),压力(影响气体分子的所占的容积)的影响,能量分配。
- 第二个公式,我们可以看出热力学第二定理的几种表述是怎么来的
- 首先是克劳修斯表述,我们看孤立系统中的两个物体,一个高温,一个低温,高温的分母大,所以要是的系统的熵增加,只能是高温的物体放热,低温的吸热
- 其次是开尔文表述,热本质上是一种能量(分子动能),在热能变为机械能的过程中,为分子的无序动能变为机械的有序运动,是熵减的,为了熵增,必须有部分的热能耗散到周围的低温环境中,使得环境的熵增,且数值大于熵减的部分
- 第二个公式基本上是适用于系统的内部没有熵产时的,Q是外界传入的热量。实际上系统内部会有着各种的原因使得在没有外界的干扰的情况下,自身变得混乱。
热过程不可逆性
-
不可逆过程:一旦使系统从某一状态过渡到另一状态,就无论使用什么方法都不能使系统从后一状态回到前一状态,而不引起任何变化。
-
则两个系统必须具有不同的性质。
可逆过程
- 定义:恢复到原始状态,不遗留任何变化,则称为可逆过程
- 条件:满足力、热、相、化学平衡
热力学第二定理:
- 克劳修斯:热量不能自发地从低温物体传向高温物体。这一表述强调了热量传递的方向性。(强调自发地、不付代价)
- 开尔文:不可能从单一热源取热使之完全转换为有用的功而不产生其他影响。这一表述则强调了能量转换的效率问题。
卡诺定理:
结论:
- 不可能制造出在两个温度不同的热源间工作的热机,而使其效率超过同样热源间工作的可逆热机。
- 在两个热源间工作的一切可逆热机具有相同的效率。
热力学温度标尺
$$ \eta =1-\frac{T_2}{T_1} $$这里的$T_1,T_2$为热力学温标
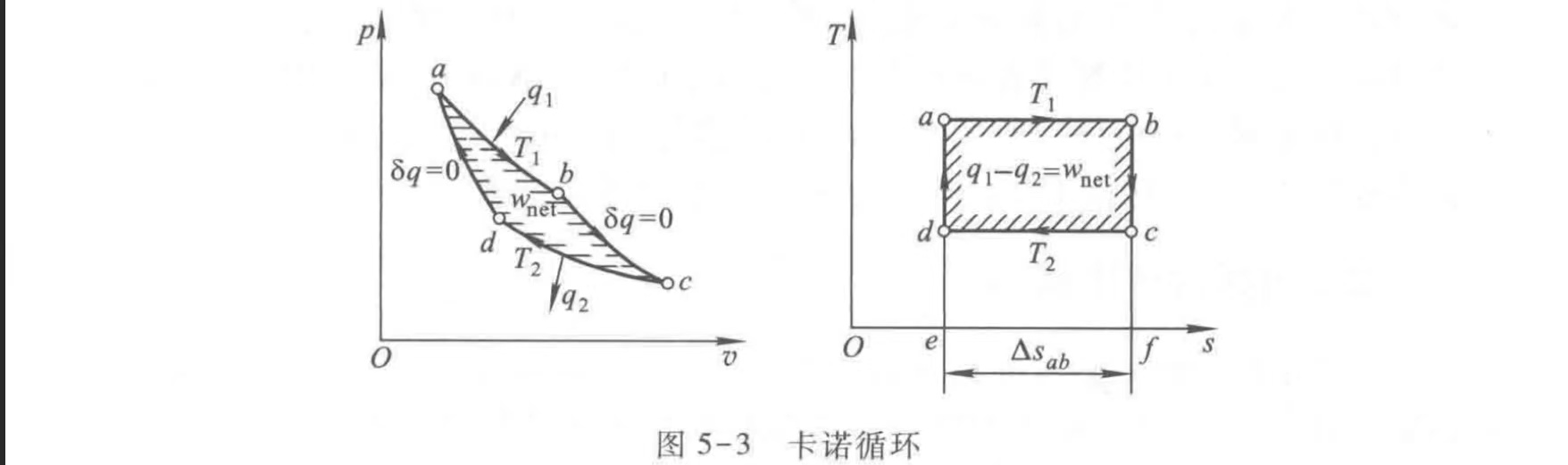
卡诺循环
$$ 1-2定温吸热过程, q_{1}=T_{1}\left(s_{2}-s_{1}\right) \\ 2-3绝热膨胀过程,对外作功\\ 3-4定温放热过程, q_{2}=T_{2}\left(s_{2}-s_{1}\right) \\ 4-1绝热压缩过程,对内作功\\ $$- 定温-绝热-定温-绝热
$$ \eta_{t}=\frac{w_{n e t}}{q_{1}}=\frac{q_{1}-q_{2}}{q_{1}}=1-\frac{q_{2}}{q_{1}}=1-\frac{T_{2}\left|\Delta s_{c-d}\right|}{T_{1}\left|\Delta s_{a-b}\right|}=1-\frac{T_{2}}{T_{1}} $$根据循环特性,卡诺热机循环(正向循环)效率为:
以上为热机(正向循环,吸收热量,对外做工)的效率
其中$w$为对外界做的功,$q_1$为从高温热源吸收的热量,$q_2为对低温热源放出的热量$
- 即热效率=静功/吸热
对于制冷循环(逆向循环):(实际上将正向循环的公式反过来就好了(都取倒数))$\frac{t_1}{t_1-t_2}=\frac{q_1}{w}$
有:
制冷系数=$\frac{Q_1}{W}$
为向高温热源放出的热量/输入的静功
- 吸热小于放热·
卡诺定理的补充:
- 卡诺循环的热效率仅仅取决于两个热源的温度,若提高高温热源$T_1$,降低低温热源($T_2$提高工作热源温差),则能够提高循环热效率
- 若$T_1=T_2$,则$\eta=0$,说明热能产生动力一定要温差作为热力学条件,所以单一热源连续做功的机器(第二类永动机)不存在
克劳修斯不等式
- 任意循环的一般性质:
- 假定:
- 系统由任意温度T的热源得到的每一微小热量,都是由温度为To的恒温热源通过可逆机 R 供应的
- 2可逆机 R 是微小的,因而当向系统输运热量时它将完成一个或若干个循环
- 假定:
$$ \oint \frac{\delta Q}{T} \leq 0 > $$
上述为循环的一般属性()
- 注意:
- 对所讨论的热力系而言,T表示**热源(外界)**的温度(为可逆过程时,看做系统和外界的温度一样,吸热的过程是缓慢的。当不可逆时,使用外界的温度)
- 未对系统的热力过程提出任何限制,适用于任意循环
- 一切可逆循环的克劳修斯积分等于零
- 一切不可逆循环的克劳修斯积分小于零
这节的这些都是针对循环的过程而言的,对于单个的吸放热过程直接使用熵的基本计算公式就行
状态参数熵
-
任意可逆循环$\oint \frac{\delta Q}{T} = 0$
-
S表示这个状态函数——叫做熵,即:
- 只适用于可逆过程(上述的两个公式)
- T可以看做是系统的温度
可逆过程热量的计算
$$ \begin{array}{c} \mathbb{Q = T d S} \\ Q_{1-2}=\int_{1}^{2} \mathbb{Q}=\int_{1}^{2} \operatorname{TdS} \end{array} $$- 吸热,熵增加(温度T恒大于0)
- 放热,熵减少
- 绝热,熵不变
- 可逆过程中可利用态函数熵的增减来判断过程中系统与外界热交换的方向
示热图(T-S图)
- 可用面积将可逆过程中交换热量表示出来。T-S图又称为示热图
- 在可逆过程中,热流穿过边界必将引起热力系熵的变化,而可逆功的传递与系统中的熵变化无关
熵增
-
熵的变化
在任意不可逆过程中,熵的变化量大于该过程中加入系统的热量除以热源温度所得的商
- 变化的计算
- 熵是一个状态量,其在任意过程中的变化量只与初终状态有关,而与过程如何进行无关,即:
- 不可逆过程熵的变化可以选择相同的初终态间的任意的可逆过程来计算
熵方程
- 热力学第二定理表达式:
- 可作为热过程进行方向的判据
- 前面讲过的热力学第二定律的种种说法和推论都可概括在上述表达式中
闭系的熵方程
- $$ > dS=\frac{\delta Q}{T}+dS_g > $$
开系的熵方程
- 可稳定流动过程: $$ > S_1-S_2=\int_1^2\frac{\delta Q}{T} > $$
其中$\frac{Q}{T}$为熵流,即外界与系统进行热交换所引起的熵变(正负也是取决于吸热或放热)
$ds_g$为熵产,即系统内部由于不可逆的热过程而产生的熵增,是恒大于0的
- 所以才会有$\Delta S\geq\frac{Q}{T}$的公式,Q为从外界吸收的热量,而单个的热源由于没有内部的熵产,所以取等号;对于内部发生不可逆过程的系统,取>。
做题之后的一些感想:
上面这些和做题有什么关系吗????
熵是什么呀?
有一个理想的热机,有一个热源,一个冷源(这个热源和冷源的温度可能是固定的,也可能是有比热容,传热的)
-
对于有比热容的两个热源:
可逆过程
利用熵变进行计算:
-
$$
\Delta S=mcln\frac{T_2}{T_1}
$$
这是由熵的定义积分得到的
-
两个物体都是这样,同时由于为可逆过程,因而两个热源的熵变之和为0,可以得到两者最终温度之间的关系
-
现在知道两个热源的起始,最终温度,可以算出吸收,放出热量,从而算出功
不可逆过程:
- 当不可逆时,不建议使用上面1的公式,因为没有相加为0的关系了,可以根据已知得到始末的温度,后面热量和功的计算与可逆过程相同
- 但是由于不可逆,会引入熵增的概念
- 知道始末温度,利用公式计算两个热源熵的改变量,相加即可
-
$$
\Delta S=mcln\frac{T_2}{T_1}
$$
-
对于恒温的两个热源:
可逆过程
-
由于是恒温的过程,之前计算热效率的公式可以利用了(恒温,T不变,不用使用积分的形式),根据冷热源的温度计算效率,得出吸热、放热、做功三者之间的关系
-
$$
\Delta S=\frac{Q}{T}
$$
Q为吸热放热的量(吸热为正值,放热为负值)
不可逆过程
- 不可逆过程,同样使用那个公式,分别算出在两个热源中的熵增,相加即可
-
- 只有热传递才会产生熵的变化,做功不会使熵发生改变
- T为热源的温度,不过在可逆过程中热源温度与系统温度是相等的(想象成无数段微分吗)
热力系的有效能
- 有效能:不同情况下系统所能完成的最大功量
- 假设在压力,温度为常数的条件下
热量的有效能:
- 热量 Q 中可能转变为功的部分,也就是之前的W,为吸收和放出热量的差值
工质的有效能
- :工质在与环境相互任用下,从任意状态过渡到与环境相平衡的状态所能完成的最大功量
- 闭系
- 开系
- 其他系统
- 定温-定容系统
- 定温-定压力系统
有效能损失
- 在参数为 P0 ,T0 的环境中,由于能量的耗散(或贬值)引起的可用能损失恒等于 $T_0dS_g$
第二定律的统计解释
- 对于大量分子组成的系统:
- 在空间均匀分布的概率大,不均匀分布的概率小(自由膨胀)
- 能量在各个方向平均分布的概率大,某个方向具有较大能量的概率小(功-热)
- 分子间能量平均分配的概率大,不平均分配的概率小(高温-低温)
热力学一般关系
- 研究对象:简单可压缩工质(具有普适性)
- 特点:存在两个独立的状态参数,其状态函数为二元函数
- 简单可压缩系统:可压缩系统与外界只有准静态体积变化功(压缩或膨胀功)交换(即功全部来自于体积功)
- 5个简单可压缩系统的基本状态参数:
- 压力p(力学参数)
- 比体积v(位移变量)
- 温度T(热力学第0定理)
- 热力学能u(热力学第一定理)
- 熵s(热力学第二定理)
$$ du=Tds-pdv $$其中3个可测基本状态参数p,v 和T 的函数关系F(p,v,T )=0称为状态方程
式子为基本热力学关系,包含了5个热力学参数,为$u(s,v)$的全微分

首先是将u两边的物理量写成微分的形式,在此基础上对应相乘对角线上的物理量(注意,微分的时候应该将-号去掉)
全微分
$$ d u = T d s-p d v\\ { 即:热力学能 } = \text { 吸热量 }- \text { 做功量 }\\ d h = T d s+v d p(\text { 焓 } h = u+p v) \\ d f = -T d s-v d p(\text { 引入自由能 } f = u-T s) \\ d g = -s d T+v d p(\text { 引入自由焓 } g = h-T s) $$第一个公式是最基本的,包含了五个基本的热力学参数,是s关于u,v的偏微分,后面的是根据关系式的推导,上述的变换称为l变换
偏微分与麦克斯韦关系式
重要的偏微商关系:(实际上是利用全微分方程的性质推导的)
写成全微分的形式,因为前面的系数为全微分系数
- 这是对四个基本参数的偏微分表示(一阶偏微商关系)
麦克斯韦关系式:(二阶混合偏微商)同样使用全微分方程的性质,主要的是一阶的方程
- $$ \frac{\partial}{\partial T}\left(\frac{\partial g}{\partial p}\right)_{T}=\frac{\partial}{\partial p}\left(\frac{\partial g}{\partial T}\right)_{p} \\ \left(\frac{\partial v}{\partial T}\right)_{p} =-\left(\frac{\partial s}{\partial p}\right)_{T} \\ \frac{\partial}{\partial T}\left(\frac{\partial f}{\partial v}\right)_{T} =\frac{\partial}{\partial v}\left(\frac{\partial f}{\partial T}\right)_{v} \\ \left(\frac{\partial p}{\partial T}\right)_{v} =\left(\frac{\partial s}{\partial v}\right)_{T} $$
其中两个一阶的关系:将不可测的熵s的偏微商与可测的基本状态参数p,v,T的偏微商相关联
重要的热系数
定容比热容
$$ c_v=(\frac{\partial u}{\partial T})_v $$定压比热容
$$ c_p=(\frac{\partial h}{\partial T})_p $$当然,比热容还可以写成在对应的物理量不变的情况下(体积或者是压强),热量比上温度的变化量。
绝热节流系数
$$ \mu_J=(\frac{\partial T}{\partial p})_h $$基本方程
将之前的基本的全微分方程加入基本的热系数变形之后的式子
熵方程
$$ d s =\left(\frac{\partial s}{\partial T}\right)_{v} d T+\left(\frac{\partial s}{\partial v}\right)_{T} d v \\ =\frac{c_{V}}{T} d T+\left(\frac{\partial p}{\partial T}\right)_{v} d v \\ d s =\left(\frac{\partial s}{\partial T}\right)_{p} d T+\left(\frac{\partial s}{\partial p}\right)_{T} d p \\ =\frac{c_{p}}{T} d T-\left(\frac{\partial v}{\partial T}\right)_{p} d p $$热力学能方程
$$ d u =\left(\frac{\partial u}{\partial T}\right)_{v} d T+\left(\frac{\partial u}{\partial v}\right)_{T} d v \\ =c_{V} d T+\left(T\left(\frac{\partial s}{\partial v}\right)_{T}-p\left(\frac{\partial v}{\partial v}\right)_{T}\right) d v \\ =c_{V} d T+\left[T\left(\frac{\partial p}{\partial T}\right)_{v}-p\right] d v $$焓方程
$$ \begin{aligned} d h & =\left(\frac{\partial h}{\partial T}\right)_{p} d T+\left(\frac{\partial h}{\partial p}\right)_{T} d p \\ & =c_{p} d T+\left(T\left(\frac{\partial s}{\partial p}\right)_{T}+v\left(\frac{\partial p}{\partial p}\right)_{T}\right) d p \\ & =c_{p} d T-\left[T\left(\frac{\partial v}{\partial T}\right)_{p}-v\right] d p \end{aligned}\\ $$热力学基本关系式
- $(\frac{\partial c_{V}}{\partial v})_T,(\frac{\partial c_p}{\partial p})_T$与状态方程间的关系由上述热力学能与焓的微分式可得:
$当给出较准确的状态方程以及某一压力 p_{0} 下测得的比定压热容数据 c_{p 0}(T) ,可以通过积分算得函数关系 c_{p}(T, p) :$
$$ c_{p}(T, p)=c_{p 0}(T)-T \int_{p_{0}}^{p}\left(\frac{\partial^{2} v}{\partial T^{2}}\right)_{p} d p $$- $比热容差 \left(c_{p}-c_{v}\right) 与状态方程关系$
- 绝热节流系数的一般关系式
这节一些公式(比如求熵、焓、热力学能的变化是针对所有的热力学系统的),所以要和之后几章的针对理想气体的公式区别开,后面的实际上是一种近似的处理。
气体的热力性质
气体、液体、固体
可以看做是气体的:
- 气体的比体积大而气体分子自身所占体积相对极小
- 分子间的平均距离大而分子间的相互作用力很小
- 可以忽略分子自身所占的体积和分子间相互作用力对宏观热力性质的影响
总的来说就是分子自身不计体积,不计分子之间的作用力
理想气体状态方程
$$ pV=nRT=mR_gT $$- 针对质量为m或者是物质的量为n的气体
理想气体的热系数
- 体膨胀系数
- 等温压缩率
- 压力的温度系数
理想气体比热容偏微商
- 比定容热容:
- 比定压热容:
-
在恒定温度下,理想气体比定容热容不随比体积变化,比定压热容不随压力变化
-
理想气体的比定容和比定压热容都是温度的单值函数
绝热节流系数
- 理想气体的绝热节流系数恒为零
- 理想气体经过绝热节流后温度不变
做题的一些感受
- 首先是将上述的所有方程分一下类
- 基本的四个全微分方程(一般是使用前面的全微分的形式,后面的形式也要注意)
- 对$p,v,T,s$的一阶偏微分的表达式,不怎么会使用到
- 麦克斯韦关系式,一般是使用一阶的那个,有$p,v,T$中的两个与s之间的关系
- 熵,焓,热力学能方程,最重要的关系式,将三个不可测量的量使用基本的$p,v,T$还有热力学的热系数表示
- 解题:
- 首先下标一样的才可以化简(也就是不变的物理量量相同)
- 出现$p,v,T$三者之间的式子,可以使用麦克斯韦化简,变为含有熵的方程
- 出现熵,焓,热力学能不变的方程(这三个在脚标的位置)时,要学会使用熵方程,不变是意味着微分=0
一般来说,常用的有三种方程,其中焓、熵这些方程最重要,基本方程主要是带入将微分形式展开,麦克斯韦方程主要是解决p,v,T出现的方程
蒸汽的热力性质
感觉本章主要是图、表的使用
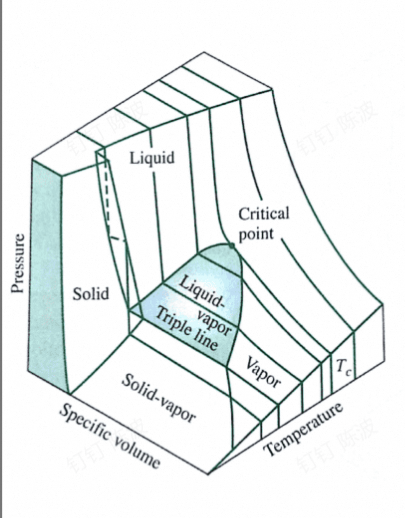
蒸气立体图
不是蒸汽(蒸汽或汽通常指水蒸气)
蒸气在其工作参数范围内既可呈现为气态、亦可呈现为液态,存在气-液相变的气化和凝结过程
单元工质的pvT立体面
- 三块单向区,状态由任意两个参数确定
- 三块两相区:气-液、固液、气固
- 在相变时可以两相共存,此时的压力和温度不是相互独立的变量(因为必须在相变的线上),但是,比体积和压力(或温度)可以确定状态
- 三相线上,气液固可以共存
- 相变的起始或终止状态称为饱和态,饱和态的温度和压力是相对应的
- 中间的拱形区是气液两相区,围成它的两边的曲线分别是饱和液和饱和气线(阴影区域)
- 在**饱和线(相界面线)**上工质可以进行平衡的相变过程
- 拱形的顶部,即两条饱和线的交点是临界点(临界温度和临界压力)
- 临界温度是气液两相可共存的最高温度
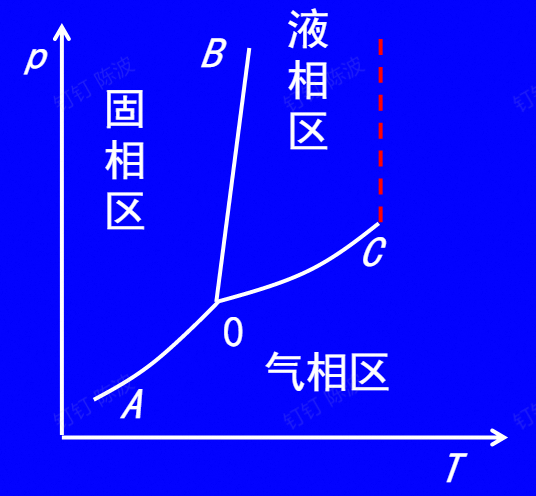
相图(P-T)
- 0-B是熔化线
- 0-C是气化线,C为临界点
- 在临界状态,饱和气和饱和液相区的各个热力性质均相等
- 在超临界压力时,气液相变不经历两相平衡共存的饱和态,通常以临界定温线作为气、液两个相区的分界
虚线为临界线,线右侧的区域全为气相区域,无论多大的压力都不能液化
p-V图
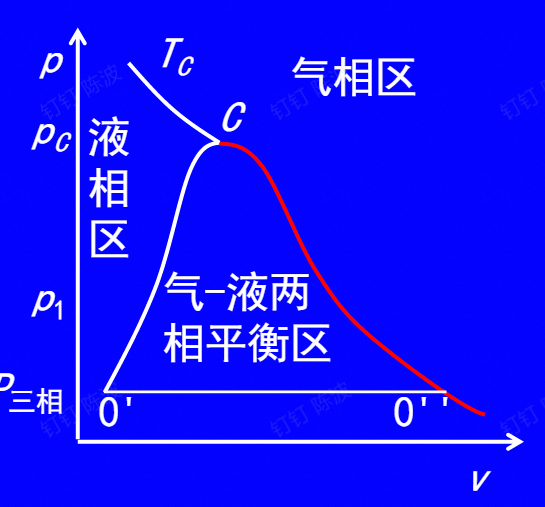
- 除了临界点外,饱和气和饱和液有不同的体积比
- 在p-v图上,气化线展开成2条即饱和液线(0’-C)和饱和气线(0’’-C)
- 三相点展开成三相线0’-0''
- 在临界压力以上不存在气-液两相平衡区(以定温线分隔两区)
- 在图中,相变时,$p,T$之间有关系,相变时,温度和压强不会发生变化(在外界稳定的情况下),所以横线为相变(既是等温的也是等压的线,有气有液)的过程。
- 当体系的容积改变时,气、液的比例会发生改变,从而使得T、p不变。(即横线从左到右)
- 线段中间的点表示不同质量比的两相混合物,为湿饱和气
- 由图,以气 - 液两相为例,随着温度升高,气体和液体的性质逐渐趋近,也就是超过临界压力时,不会有相变过程的原因
- 一定压力下1 kg饱和液转变为液饱和气吸收的热量称为汽化潜热(定压相变过程温度恒定): $$ r=h^{\prime\prime}-h^{\prime}=T_s(s^{\prime\prime}-s^{\prime}) $$
热力平衡的判据
- 平衡的自由能判据:在温度和体积不变的条件下,封闭系统的自发过程朝自由能减小的方向进行,系统平衡态自由能(功势函数)最小
- 自由能——定温定容系统 自由焓——定温定压系统 热力学能——定熵定容系统 焓——定熵定压系统
液体加热气化
加热阶段
-
由不饱和液吸热变为饱和液,始终为单一的液相
-
$$
q=h^{'}-h_0
$$
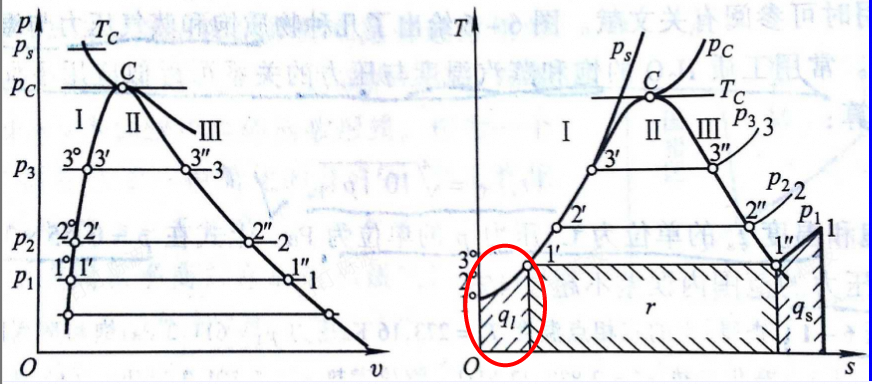
为T-s图上左侧曲边梯形的面积?
气化阶段
-
相变的阶段,由饱和液变为饱和蒸气
-
比体积,焓,熵增加
-
$$
r=T_s(s{''}-s{'})
$$
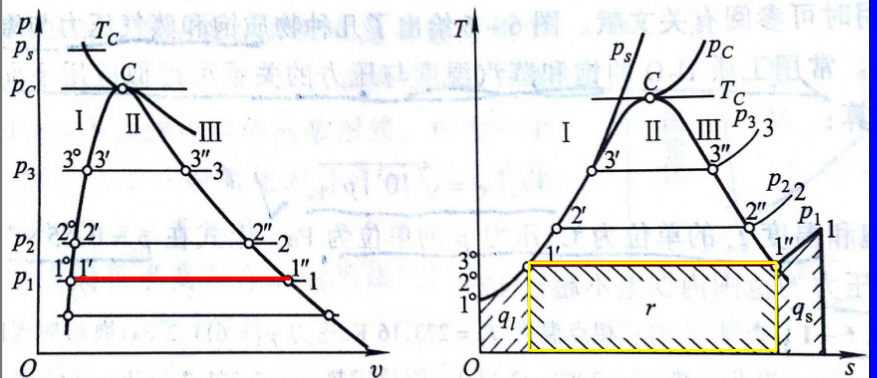
干度
-
横线中间点为饱和液和饱和气的混合物(湿蒸气)
- $$ X=\frac{m^{\prime\prime}}{m^{\prime}+m^{\prime\prime}}=\frac{m^{\prime\prime}}{m} $$
-
1-x为湿度
过热阶段
-
对饱和蒸气继续加热,温度超过饱和温度的阶段,此时的工质称为过热蒸气,超出的温度值称为过热度(T-Ts)
-
工质在过热阶段吸收的热量等于过热与饱和蒸气的焓差
-
$$
q=h-h{''}
$$
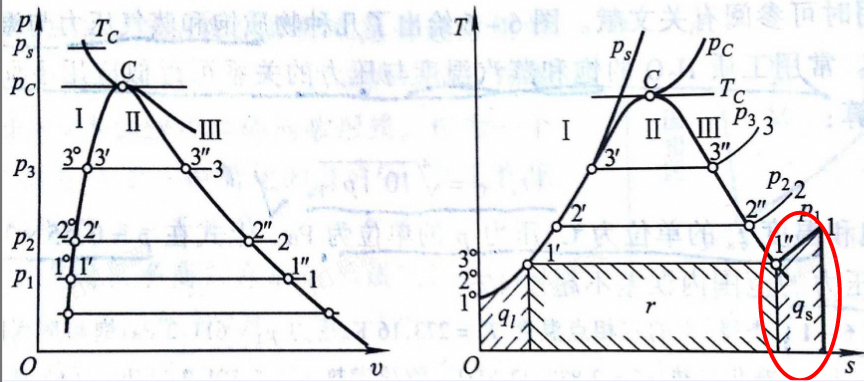
随着压力的提高,蒸气定压发生过程线在p-v图上平行上移
- 由于饱和温度相应提高,T-s图上的过程线亦向上移动
- 当压力到达临界压力时,定压线通过临界点C
- 此时,临界温度以下是液体加热阶段,临界温度以上是蒸气过热阶段,临界点上饱和液和饱和气的参数相同
- 临界点是临界定温线上具有水平切线的拐点
- 在超临界压力下,蒸气发生过程不经过气-液平衡两相区,不经过特殊的相变点,工质由液态到气态是在连续渐变中完成的,过程中总是呈现为均匀的单相
热力性质表
未饱和水、饱和水、湿蒸汽、饱和蒸汽、过热蒸汽 5 种状态
- 液体的参数计算
- 是蒸汽的参数计算
- 过热蒸汽的参数计算
饱和液和饱和蒸气热力性质表
- 两相共存时,有一个独立的参数(给定一个p/T,就能知道饱和的压力,温度)
- 气-液平衡的饱和态只出现在三相点以上、临界点以下,故表的参数范围为三相点至临界点
湿蒸气热力性质的计算
$$V_{x}=(1-x)V'+xV''=V'+x(V''-V')$$$$h_{x}=h'+x(h''-h')=h'+xr$$$$s_{x}=s'+x(s''-s')$$
饱和液的比体积v’和饱和蒸气的比体积v’’,x为干度
不饱和液和过热蒸气热力性质表
图
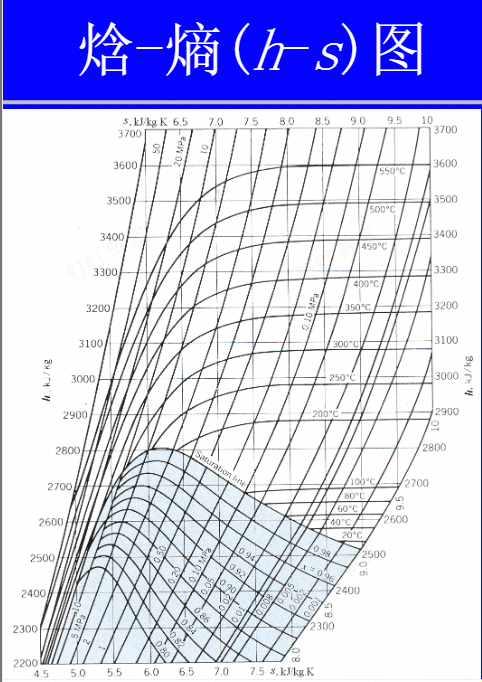
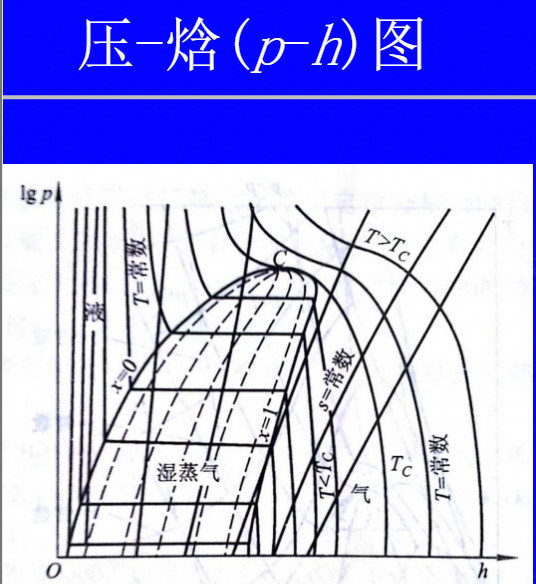
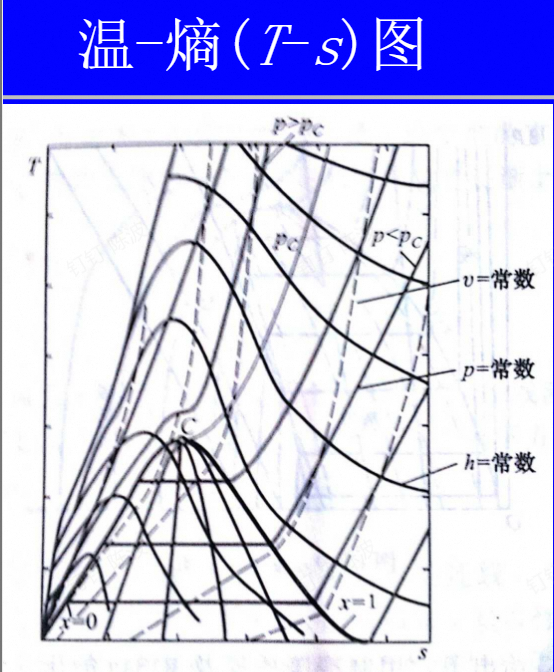
小结

理想气体混合物和湿空气
成分计算、摩尔质量和气体常数计算
- 质量分数$w_i$
- 体积分数$\varphi_i$
- 摩尔分数$x_i$
分压定理和分体积定理
混合物的u,h,c,s计算
前提:任一组元所处的状态不受其他组元的影响
- $$ \begin{aligned} & 1kg,u(T)=\sum_{i}w_{i}u_{i}(T) \\ & 1mol,U_{m}(T)=\sum_{i}x_{i}U_{m,i}(T) \end{aligned} $$
- $$ \begin{aligned} & h=u+pv=u+RgT \\ & h\left(T\right)=\sum_{i}w_{i}u_{i}\left(T\right)+\sum_{i}w_{i}R_{g,i}T \\ & =\sum_{i}w_{i}[u_{i}(T)+R_{g,i}T] \\ & =\sum_iw_ih_i(T) \\ & H_{m}(T)=\sum_{i}x_{i}H_{m,i}(T) \end{aligned} $$
-
比热容,和上面的同理
-
熵,$s(T,p)=\Sigma_iw_is_i(T,p_i)$
湿空气及状态参数
- 湿空气:干空气和水蒸气的混合物
- 水蒸气的含量是变量
$$ \begin{aligned} & d=\frac{m_\mathrm{v}}{m_a}=\frac{\frac{p_\mathrm{v}V}{R_\mathrm{v}T}}{\frac{p_aV}{R_aT}}=\frac{p_\mathrm{v}R_a}{p_aR_\mathrm{v}}=\frac{p_\mathrm{v}\times287}{p_a\times461.9} \\ & =0.622\frac{p_\mathrm{v}}{p-p_\mathrm{v}}=0.622\frac{\phi p_\mathrm{s}}{p-\phi p_\mathrm{s}} \end{aligned} $$
绝对湿度$m_V$:每立方米湿空气中所含的水蒸气的质量$AH=\frac{m_\text{水蒸气}}{V_\text{空气}}\quad(\text{单位:g/m}^3)$
相对湿度:使用当前水蒸气的分压/当前温度下饱和水蒸气的分压
$\phi=\frac{p_v}{p_s}$,越干燥,吸水能力强
含湿量d:每kg的干空气中含有的水蒸气的数量
未饱和湿空气和饱和湿空气
- 未饱和湿空气(干空气+过热水蒸气)
- 饱和湿空气,温度一定时,不能再加入水蒸气
比较
从未饱和变为饱和途径
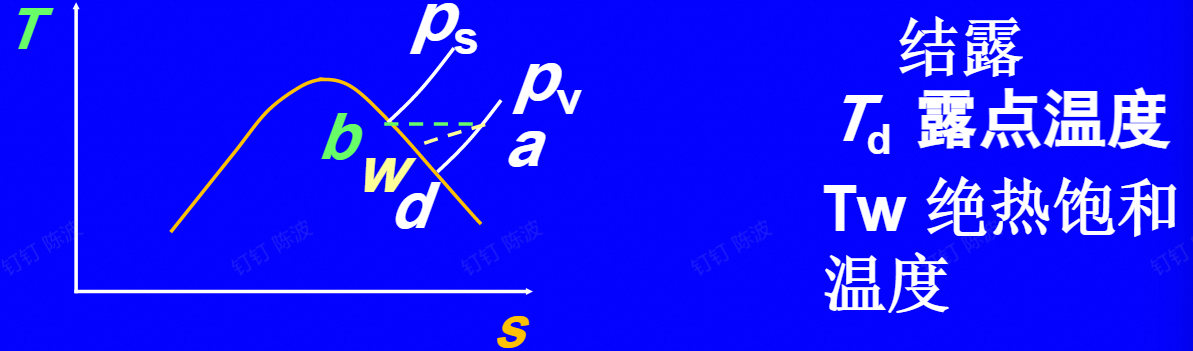
- a-b:加水蒸气,温度不变
- a-w:绝热,$T_w$绝热饱和温度
- a-d:压强不变,$T_d$露点温度
$$ h_a=c_pt=1.005t\\h_\mathrm{v}=2501+1.863t\\h=1.005t+d(2501+1.863t) $$取0℃时的两者的焓为0,作为基准
为将干空气的焓与水蒸气的焓×含湿量相加
干-湿球温度计
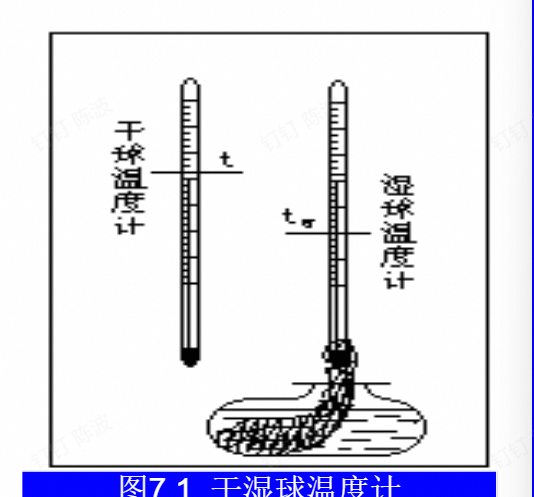
图
焓湿图(h-d)
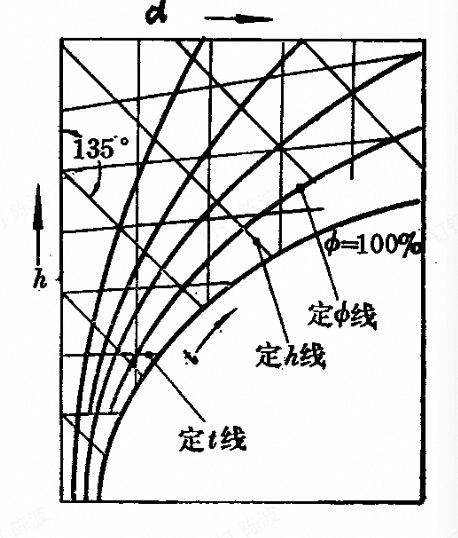
- 横轴为d线,d=0时为干空气
- 人为将h线旋转了135°(图中的斜线为等h的线)
- 横线为等温线
- 曲线等相对湿度
t线
$$ \begin{aligned} & \left(\frac{\partial h}{\partial d}\right)_t= \\ & 2501+1.863t \\ & =Const>0 \end{aligned} $$等$\Phi$线
向上凹的曲线,饱和线上方为未饱和线,下部无意义
湿空气的过程
单纯的加热或冷却的过程
d不变
在焓湿图中为与y轴平行的直线
$q=h_2-h_1$
冷却去湿过程
先是等湿度的降温,再降低湿度(降温,空气中能含有的最多的蒸气量下降,但是实际的蒸气量不变,相对湿度上升)(当到1时,无法容纳更多的水蒸气,开始析出)
$$ h_1=h_4+ \begin{bmatrix} d_1-d_4 \end{bmatrix}h_\text{水}+ \begin{vmatrix} q \end{vmatrix} \\ \begin{vmatrix} q \end{vmatrix}=h_1-h_4- \begin{bmatrix} d_1-d_4 \end{bmatrix}h_\text{水} $$绝热加湿过程
- 向空气中喷水,气化潜热,蒸发冷却
湿度上升,相对湿度上升,温度下降
$$ h_1+(d_2-d_1)h_水=h_2 $$绝热混合过程
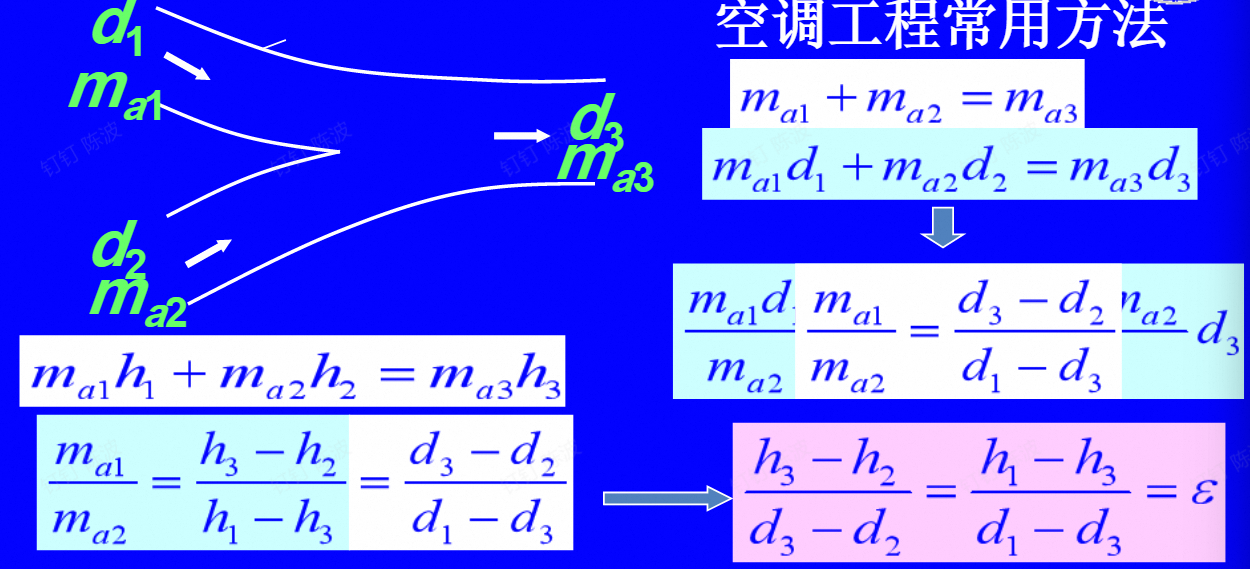
todo
- 三种图表的使用(定压时的饱和,定温时的饱和,定容时的未饱和和过饱和的数据)
- 图像的读法
- 解题的步骤和注意点
- 熵增的进一步说法
理想气体的热力学过程
$$ Pv=R_gT $$其中的$R_g$为气体的气体常数
$$ du=c_vdT\\ dh=c_pdT\\ ds=c_p\frac{dT}{T}-R_g\frac{dp}{p} $$对于理想气体,有(u和h为温度的单值函数),所以对于理想气体,温度不变时,两者是不变的
两个比热容与温度也有关,但是在计算精度要求不高的场合,看做两者不变
研究对象
- 简单可压缩系统
- 理想气体
- 可逆过程
的
- 能量转换:q,w,wt
- 状态变化:p,v,t,u,h,s
$$ \delta q=du+\delta w=dh+\delta w_t\\ w=\int pd\nu\quad w_t=-\int\nu dp\quad q=\int Tds\\ \Delta u=\int c_\mathrm{v}dT\quad\Delta h=\int c_\mathrm{p}dT\\ \begin{aligned} & \Delta s=\int_1^2c_\mathrm{v}\frac{dT}{T}+R\ln\frac{\nu_2}{\nu_1} \\ & =\int_1^2c_\mathrm{p}\frac{dT}{T}-R\ln\frac{p_2}{p_1}=\int_1^2c_\mathrm{p}\frac{d\nu}{\nu}+\int_1^2c_\mathrm{v}\frac{dp}{p} \end{aligned}\\ ds=\frac{dQ}{T} $$$$ Cp-Cv=RgCp/Cv=rCp=rRg/(r-1)Cv=Rg/(r-1) $$$$ c_p-c_v=R_g $$$$ \gamma=\frac{c_p}{c_v} $$公式总结
说明
- 热量q与是否绝热有关,绝热的系统没有热量的产生
- 热力学能与焓的变化只与温度的变化有关,等温过程没有两者的变化
- 熵增与温度和压强的变化都有关
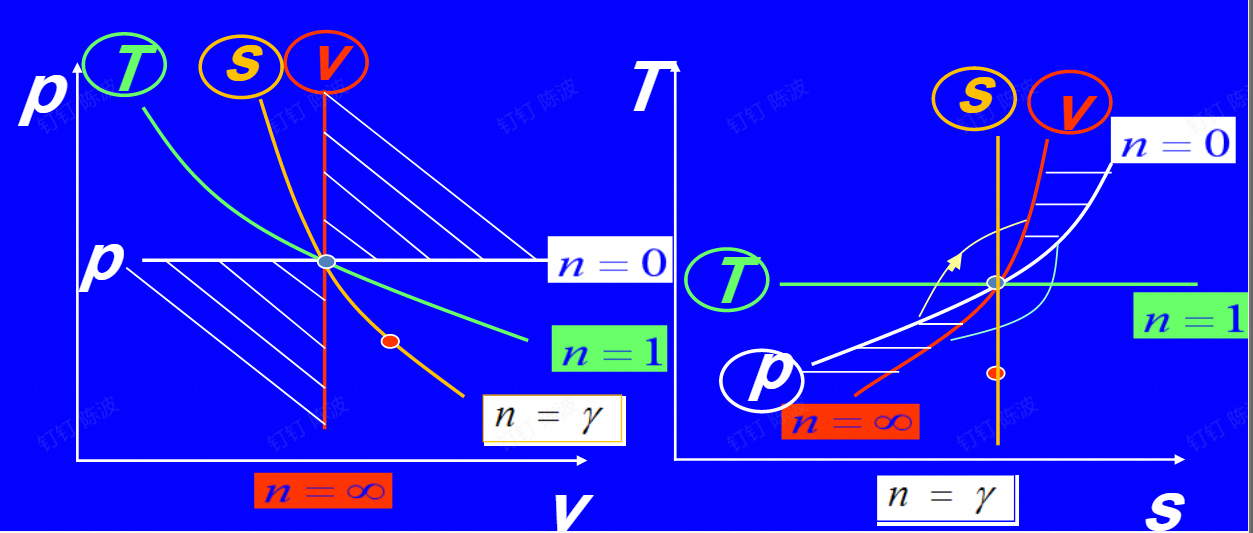
多变过程的分析计算
多变,即$pv^n=const$
- $$ \frac{p_{2}}{p_{1}}=\left(\frac{v_{1}}{v_{2}}\right)^{n} \quad\frac{T_{2}}{T_{1}}=\left(\frac{v_{1}}{v_{2}}\right)^{n-1} \quad\frac{T_{2}}{T_{1}}=\left(\frac{p_{2}}{p_{1}}\right)^{\frac{n-1}{n}} $$
- $$ w=\int p d v=\frac{R}{n-1}\left(T_{1}-T_{2}\right)\\ w_t=nw $$$$ \begin{array}{l} q=\Delta u+w=c_{v}\left(T_{2}-T_{1}\right)-\frac{R}{n-1}\left(T_{2}-T_{1}\right)\\ =\left(C_{0}-\frac{R}{n-1}\right)\left(T_{2}-T_{1}\right)=\frac{n-\gamma}{n-1} C_{0}\left(T_{2}-T_{1}\right)=C_{n}\left(T_{2}-T_{1}\right) \end{array} $$$$ C_{n}=\frac{n-\gamma}{n-1} C_{v} $$
多变过程的分析,$C_n$为n下的比热容

基本热力过程的功能
- 体积功
- 技术功
- 热量
图像
气体与蒸气的流动
稳定流动的基本方程
连续性方程
$$ \frac{dA}{A}+\frac{dc_f}{c_f}-\frac{dv}{v}=0\\ q=\frac{Ac_f}{v}为定值 $$上述方程建立了流速、截面面积和比体积(密度)之间的相互关系,普遍适用于稳定流动的过程,与流体的性质无关
能量方程
即上述的q,w方程
熵方程
第三章中推导的方程
等熵过程
$$ Ma=\frac{c_f}{c} $$$$ \frac{dA}{A}=(Ma^2-1)\frac{dc_f}{c_f} $$Ma为马赫数,c为声速
$$ c=\sqrt{\gamma R_gv}=\sqrt{\gamma R_gT} $$速度与焓之间的关系
$$ \frac{1}{2}(c_{f2}^2-c_{f1}^2)=h_1-h_2 $$焓与温度也有关系,则已知始末温度,初始速度,可以求出最终的速度
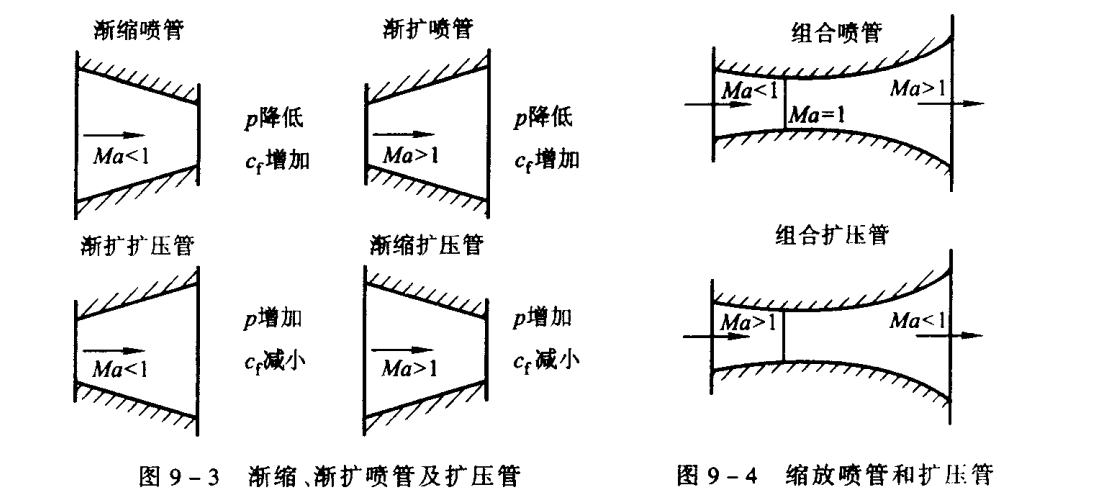
在喷管与扩压管中的流动
$$ c_{\mathrm{f,cr}}=c_{\mathrm{cr}}=\sqrt{\gamma p_{\mathrm{cr}}v_{\mathrm{cr}}}=\sqrt{\gamma R_{\mathrm{g}}T_{\mathrm{cr}}} $$
- 由等熵过程的式子可以得出,对于喷管而言,使得气体增速,在亚音速时,面积是渐渐减小的;在超音速时,面积是逐步增大的
- 对于扩压管而言,达到减速增压的目的,相反即可
- 要使的气体在管中从亚音速加速到超音速,需要缩放喷管,在最小的截面(喉部)有着临界的参数
临界的速度
喷管中的气体流动的计算
滞止参数
$$ h^{\star}=h+\frac{c_{\mathrm{f}}^{2}}{2} $$$$ \begin{gathered} c_{p}(T^{\star}-T)=\frac{c_{\mathrm{f}}^{2}}{2} \\ T^{\star}=T+\frac{c_{\mathrm{f}}^{2}}{2c_{p}} \\ p^{*}=p\left(\frac{T^{*}}{T}\right)^{\frac{\gamma}{\gamma-1}}=p\left(\frac{T}{T^{*}}\right)^{\frac{\gamma}{1-\gamma}} \\ v^{*}=v\left(\frac{T}{T^{*}}\right)^{\frac{1}{Y-1}} \\ v^{*}=\frac{R_{_{g}}T^{*}}{p^{^{*}}} \end{gathered} $$上述为滞止的温度,压强,比容的计算
$$ \begin{aligned} \mathrm{c~f2} & =\sqrt{2(h^{*}-h_{2})}=\sqrt{2c_{p}(T^{*}-T_{2})} \\ & =\sqrt{2\frac{\gamma}{\gamma-1}R_{\mathrm{g}}(T^{*}-T_{2})}=\sqrt{2\frac{\gamma}{\gamma-1}R_{\mathrm{g}}T^{*}\left(1-\frac{T_{2}}{T^{*}}\right)} \\ & =\sqrt{2\frac{\gamma}{\gamma-1}R_{g}T^{*}\left[1-\left(\frac{p_{2}}{p^{*}}\right)^{\frac{\gamma-1}{\gamma}}\right]} \\ & =\sqrt{2\frac{\gamma}{\gamma-1}p^{*}v^{*}\left[1-\left(\frac{p_{2}}{p^{*}}\right)^{\frac{\gamma-1}{\gamma}}\right]} \end{aligned} $$$$ c_{\mathrm{f,max}}=\sqrt{2\frac{\gamma}{\gamma-1}p^*v^*}=\sqrt{2\frac{\gamma}{\gamma-1}RT^*} $$出口处的流速可以由滞止的T,P,v和出口处的压强唯一确定
$$ \frac{p_{\mathrm{cr}}}{p^{*}}=\nu_{\mathrm{cr}}=\left(\frac{2}{\gamma+1}\right)^{\frac{\gamma}{\gamma-1}} $$$$ c_{\mathrm{f,cr}}=\sqrt{2\frac{\gamma}{\gamma+1}p^{*}v^{*}}=\sqrt{2\frac{\gamma}{\gamma+1}R_{\mathrm{g}}T^{*}} $$$$ \rho_{1}A_{1}v_{1}=\rho_{2}A_{2}v_{2} $$临界压力与滞止压力的比值
- 使用这个公式来计算截面积:计算密度,流速,带入,换算一下(密度和比体积相乘为)
水蒸气在流管中的定熵流动
之前的公式适用于水蒸气,不过不能使用理想气体的公式
焓变不能使用$c_p$计算
计算临界的压力比时
过热蒸汽: $\gamma=1.3$, $\nu_{\mathrm{cr}}=0.546$;
干饱和蒸汽: $\gamma=1.135$, $\nu_{\mathrm{cr}}=0.577$;
湿蒸汽: $\gamma=1.035+0.1x$
有摩擦时的流动
-
有摩擦引起的熵产$ds=\delta s_g$
-
-
速度系数
-
喷管的效率
出口实际的动能与出口的理想动能之比
-
- 由h2和p2可以确定实际的出口状态
总的解题步骤
- 先判断是不是减缩的喷管还是缩放的喷管
- 若是减缩的,就是要判断最后的压力是否大于临界的压力,若不大于,则最后的压力要取临界的压力
- 将最后的压力带入等熵的转换公式中
- 若有效率,带入即可
- 水蒸气可以使用水蒸气的焓熵图进行计算
在减缩的过程中,压力减小,温度降低,比容变大;流量变大
气体的压缩
压缩所需要的功在之前有提到过
绝热压缩: $W_{\mathrm{t,s}}=\frac\gamma{\gamma-1}p_{1}V_{1}\left[1-\left(\frac{p_{2}}{p_{1}}\right)^{\frac{\gamma-1}\gamma}\right]$
多变压缩:$W_{1, n}= \frac n{n- 1}p_{1}V_{1}\left [ 1- \left ( \frac {p_{2}}{p_{1}}\right ) ^{\frac {n- 1}n}\right ]$
定温压缩: $W_{1,T}=mR_{\mathbf{g}}T\ln \frac{p_1}{p_2}$
为负值,表示气体压缩消耗功,对外界放热
可见,放热压缩可以节省压气机的耗功量
摩擦对于压缩过程的影响
$$ \eta_{\mathrm{C,s}}=\frac{W_{1}}{W_{1}^{\prime}}=\frac{H_{1}-H_{2}}{H_{1}-H_{2^{\prime}}} $$可逆绝热过程的耗功量与实际的不可逆过程的耗功量的比值,为压气机的绝热效率
$$ \eta_{\mathrm{C.s}}=\frac{H_{2}-H_{1}}{H_{2^{\prime}}-H_{1}}=\frac{mc_{p}(T_{2}-T_{1})}{mc_{p}(T_{2^{\prime}}-T_{1})}=\frac{T_{2}-T_{1}}{T_{2^{\prime}}-T_{1}} $$$$ \frac{p_2}{p_1}=\pi $$对于理想气体来说
为增压比
活塞式压气机的余隙影响
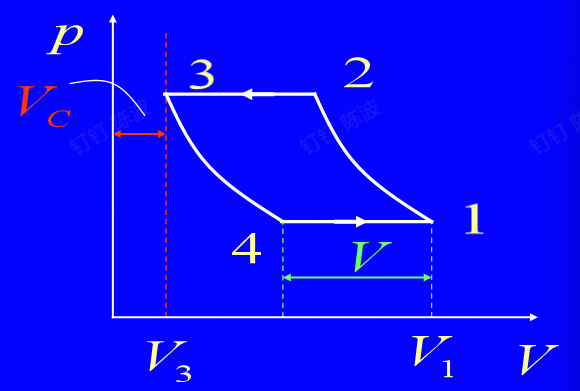
在压缩的过程中,会有空余的间隙$V_c$
研究这部分的体积对于耗功量的影响
$$ \eta_V=\frac{V}{V_\mathrm{h}}=\frac{V_1-V_4}{V_1-V_3} $$余隙对单位产气量耗功不影响
上述为容积效率
多级压缩与中间冷却
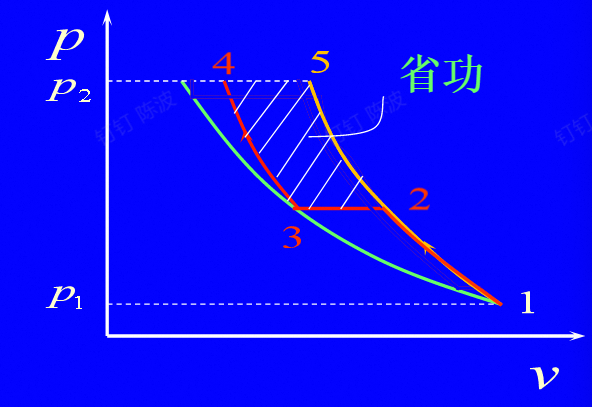
先进行第一级(低压的)压缩,进入冷却装置进行冷却(定压的过程),之后进行高压的压缩,会节省图中的阴影部分的功
$$ \frac{p_2}{p_1} $$$$ p_2=\sqrt{p_1p_4} $$$$ \pi=(\frac{p_n}{p_1})^{\frac{1}{n}} $$
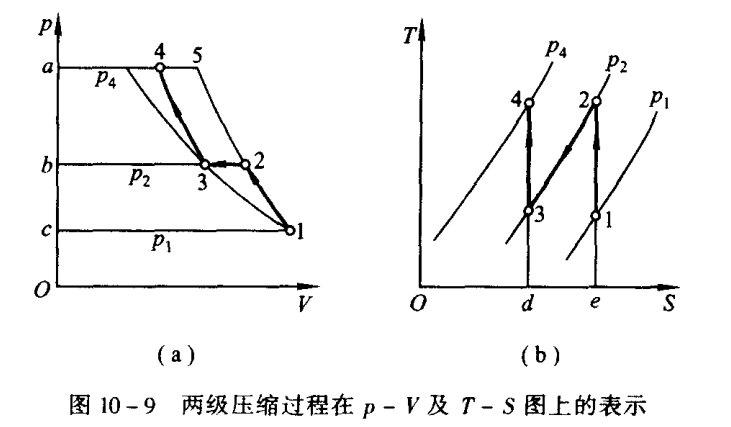
左图中右侧的线是绝热的线,左侧的线为等温的线,
要将之前的冷却到1时的温度
$$ \begin{aligned} \boldsymbol{W}_{\mathrm{t},s} & =W_{t,s}^{1}+W_{t,s}^{1} \\ & =\frac{\gamma}{\gamma-1}p_1V_1\left[1-\left(\frac{p_2}{p_1}\right)^{\frac{\gamma-1}{\gamma}}\right]+\frac{\gamma}{\gamma-1}p_3V_3\left[1-\left(\frac{p_4}{p_3}\right)^{\frac{\gamma-1}{\gamma}}\right] \end{aligned} $$$$ W_{1,s}=\frac{\gamma}{\gamma-1}p_1V_1[2-\left(\frac{p_2}{p_1}\right)^{\frac{\gamma-1}{\gamma}}-\left(\frac{p_4}{p_2}\right)^{\frac{\gamma-1}{\gamma}}] $$求导得出的最佳的压强就是上述的式子$P_2$
蒸气动力循环
概述
基础知识
热力学第一定律
$q=w$
其中 $q=\oint\boldsymbol{\delta}\boldsymbol{q}=\boldsymbol{q}_1-\boldsymbol{q}_2,\boldsymbol{w}=\oint\boldsymbol{\delta}\boldsymbol{w}=\boldsymbol{w}_T-\boldsymbol{w}_P$
$$ \eta_t=\frac w{q_1}=\frac{q_1-q_2}{q_1}=1-\frac{q_2}{q_1} $$卡诺循环效率为 $\eta_t=1-\frac{T_2}{T_1}$
其中的q和w分别是循环的净热量和净功量
$q_1,q_2$为循环吸热和放热的绝对值;
$w_T,w_p$为循环的做功量和耗功量的绝对值
蒸气卡诺循环
在一定的温度范围内,卡诺循环的热效率最高
采用湿蒸气作为卡诺循环的工质,由于水蒸气在湿蒸气的范围内压强不变时,温度不会发生变化,但是在包围的曲线外会发生变化
- 汽水混合物的压缩需要很大的压缩功,对压缩机的工作不利
- 水的临界温度低,循环的热效率不高
所以将卡诺循环改良称为朗肯循环
朗肯循环
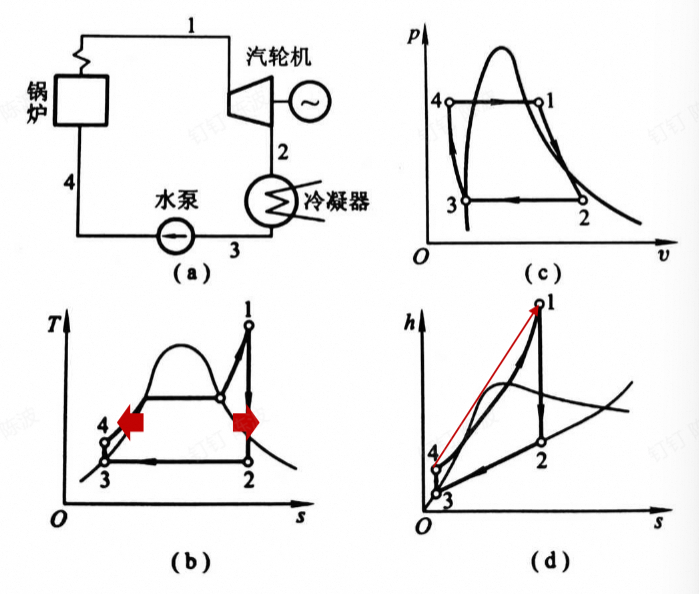
最简单的蒸气动力循环
从1开始:
绝热膨胀——定压放热——绝热压缩——定压吸热
$$ \eta_t=\frac{w}{q_1}=\frac{w_T-w_P}{q_1}=\frac{(h_1-h_2)-(h_4-h_3)}{h_1-h_4} $$$$ w_P=\begin{vmatrix}\int vdp\end{vmatrix}\approx v\Delta p=v_3(p_4-p_3) $$1.热效率
将泵功简化(使用水的不可压缩性)
$$wom,$$$$ \eta_t\approx\frac{h_1-h_2}{h_1-h_4} $$- 功比
- 汽耗率:装置每输出1Kw·h的功所需要的蒸汽量
- 相对内效率:考虑汽轮机内的摩擦,会产生熵增
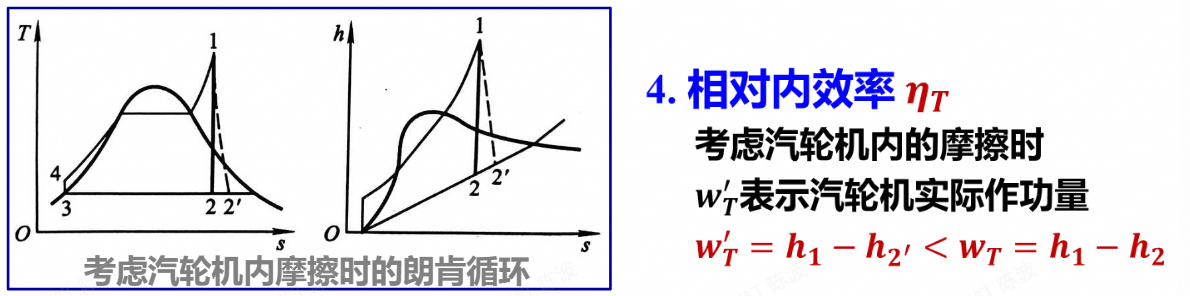
朗肯循环的优缺点
- 结构简单,但是热效率低
- 但是,都是在其基础上改进的
蒸气参数的影响
- 提高平均的吸热温度,降低平均的放热温度
- 提高初始温度有利于提高循环热效率
- 提高初始压强也有利于
- 降低终压有利于提高循环热效率
蒸气的再热循环
改变循环参数存在矛盾的现象,所以有蒸气的中间再热
实际上就是1~2过程中间进行再热,定压的加热,使T-s图中的曲线整体右移
再热循环的压力的选择
再热压力、再热次数的选择
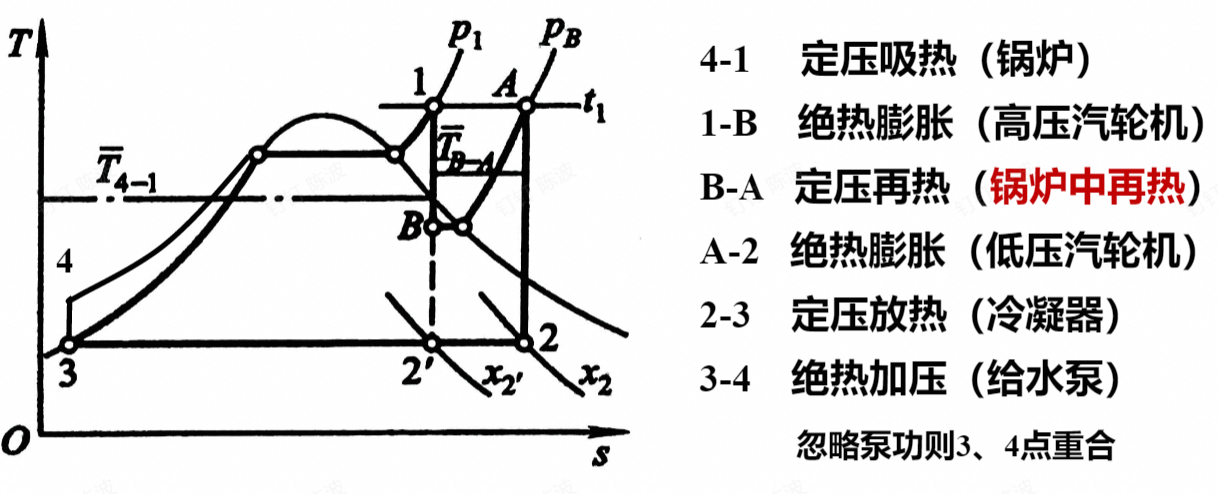

但是热效率真的提高了吗
$$ \eta_{t,1}=\frac{w}{q_1}=\frac{(h_1-h_B)+(h_A-h_2)}{(h_1-h_4)+(h_A-h_B)} $$
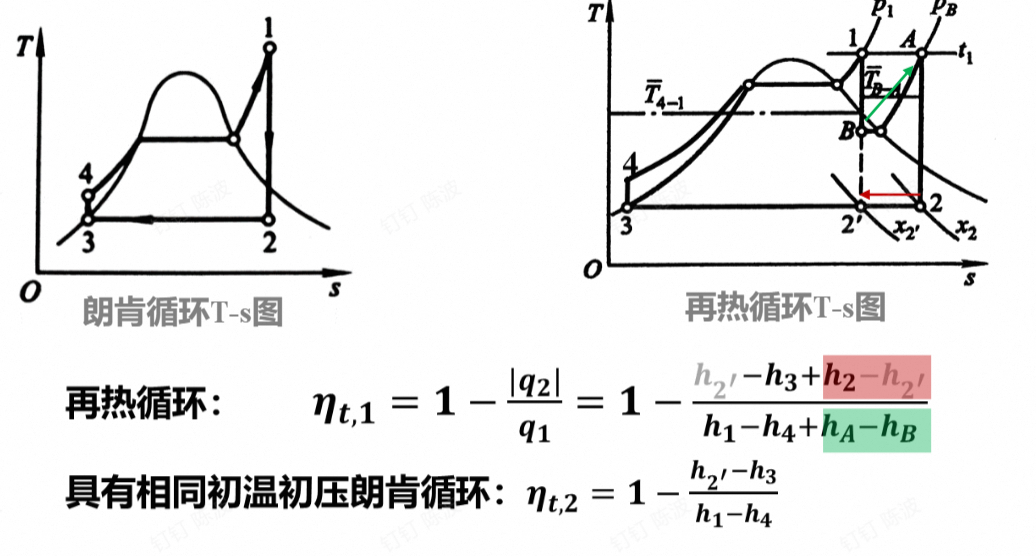
再热的循环热效率不一定提高,除非再热的压力选择合适$p_A$,此时温度差$T_{B-A}>T_{4-1}$
选择合适的再热压力(图中的右侧的曲线为等压线)使得沿着B-A的线升到同样的温度时,温度的差值大
再热循环的分析
- 再热压力的选择:
- 不能过高,使得吸热量减小,减弱热效率的提升
- 最佳的中间再热压力能同时提高泛汽干度和循环热效率
- 一般$p_A=20% - 30% p_1$(蒸气的初始压力)
回热循环
改进朗肯循环——从4-5段入手,提高平均的吸热温度

回热就是利用在汽轮机中做过功的蒸气来加热锅炉给水,减少工质在低温液态段从锅炉的吸热,从而提高平均的吸热温度,使整个循环的热效率提高。
简而言之就是,将定压放热的和定压吸热的结合
使用高温的1给低温的4加热?
分级抽气回热循环
- 抽气回热循环:分级(不同的压力),从汽轮机中抽出部分已作过一些功的蒸汽,在回热加热器中加热给水,从而减少了低温水从热源的吸热。
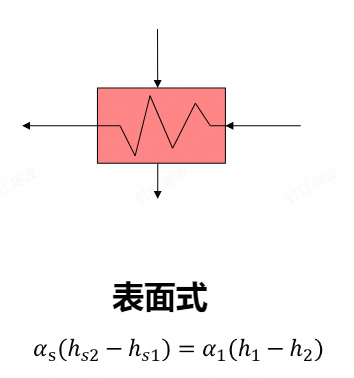
- 回热加热器:是一种换热器,用抽汽来加热给水。可以视为抽气的定压放热和给水的定压吸热过程
-
表面式
-
混合式
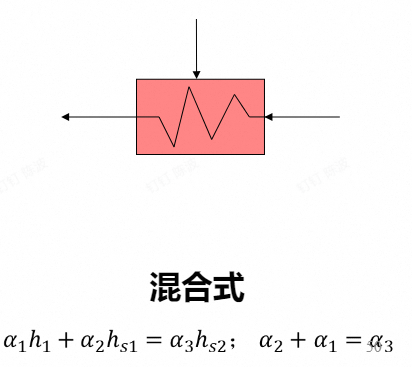
-
流量系数
-
回热循环的计算
-
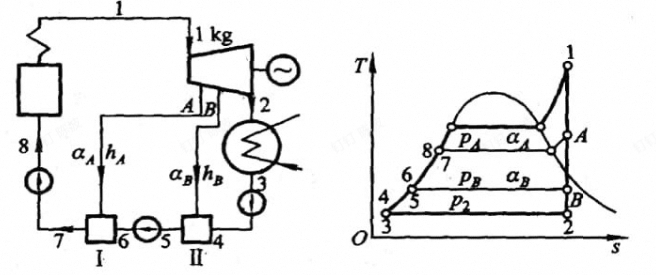
两级抽气回热循环的过程:
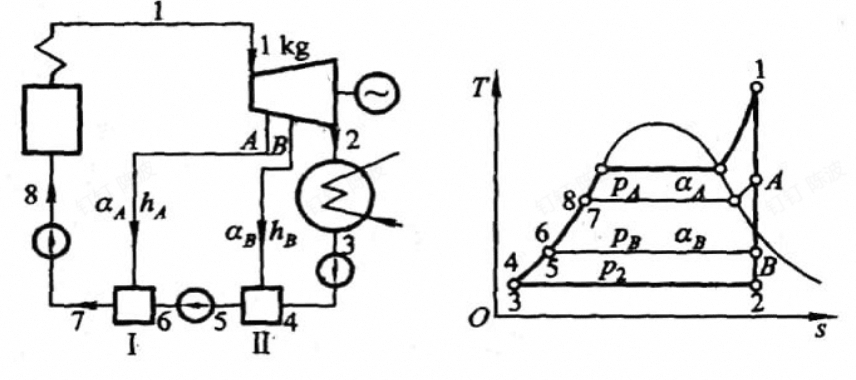
- 1状态下的蒸汽进入汽轮机中进行做功
- 压力降至A点时,抽出部分的蒸气引入一级的回热
- 其余的蒸气继续做功,至压力为B时再次引出蒸气进入第二级回热器
- 剩余的蒸气继续膨胀至冷凝器中2
- 冷凝器中变为3,经过水泵升压至二级回热器中与之前的一部分混合加热,升压至6之后与后与一级回热器混合加热
- 经过水泵升压后到达8送进锅炉中,从外部吸热变为蒸气
-
给水温度,图中7点的温度
- 是回热循环中的重要参数,与循环参数、回热级数等有关
- 采取等温升原则(将7点(回热的最高点的温度)和3点(回热的最低温度)作差,均分即可)
-
热效率分析:

循环计算:
- 计算步骤
- 确定循环的级数和给水温度
- 各级的回热器给水温升的分配和抽气的参数
- 利用各级回热器之间的质量平衡和能量平衡求出各级抽气参数
做题:
是前几章内容的一个总和
很多的东西都要靠着查表来看(水蒸气的表)
注意公式的适用性,非理想气体很多的公式是不能用的,会用到理想气体混合物和湿空气里面的知识。
求解朗肯循环:
循环中有两个等熵过程,两个等压的过程。1:过饱和蒸气;2:湿蒸气;3:饱和水;4:水
所以,在求解的过程中,1,2,3,可以使用湿蒸气的那章计算,查表
而4为水,可以3-4看做是等熵和等体积的过程,但是不能使用理想气体进行计算
- 水泵是对水做功,温度变高,压强变高。汽轮机是对外做功(主要的作用)
- 但是水部分的温度还是不会算!
但是最后的回热的循环哪里还是不太会
现在会了
首先计算每级回热的温度(即在回热器中的温度)
再使用能量守恒的方程,确定每一级的回热器离开的能量等于进入的能量,建立n个方程(n级回热),解出来答案即可
例如以上的图中,流入二级(B)的能量为右侧高温的B点的B,和左边低温的3,流出的为两者混合之后的气体,所以能量守恒的式子为
循环的功量为,基本上只看右边,分一下过程即可(看做多个循环之和)
1-A全部在做工,焓的差值为功
A-B,只有剩下的在做工,焓的差值乘以系数为功
B-2剩下的做功,同样
- $$ > \omega_{net}=h_1-h_A+(1-\alpha_A)(h_A-h_B)+(1-\alpha_A-\alpha_B)(h_B-h_2) > $$
只有7-1在吸热,焓差为吸热量
公式的适用性:
适用于理想气体的:
- 理想气体状态方程 $pV = nRT$,其中$p$为压强,$V$为体积,$n$为物质的量,$T$为热力学温度,$R$为摩尔气体常数。 该方程描述理想气体在平衡态时,压强、体积、物质的量和温度间的关系。 变形公式如$p = \frac{nRT}{V}$、$V = \frac{nRT}{p}$等。在一些特殊过程中还有不同形式:
- 等容过程:$\frac{p_1}{T_1} = \frac{p_2}{T_2}$(比容$v$为常数,即$V$不变)。
- 等压过程:$\frac{V_1}{T_1} = \frac{V_2}{T_2}$(压强$p$为常数)。
- 等温过程:$p_1V_1 = p_2V_2$(温度$T$为常数)。
理想气体内能公式:$U = nC_{V,m}T$($C_{V,m}$为摩尔定容热容),理想气体内能只与温度和物质的量有关。
理想气体焓公式:$H = nC_{p,m}T$($C_{p,m}$为摩尔定压热容)。
理想气体比热容关系:$C_{p,m} - C_{V,m} = R$。
气体分压定律:$p = p_1 + p_2 + \cdots + p_n$(混合气体总压等于各组分气体分压之和,且$p_i = \frac{n_i}{n}p$,$p_i$为组分$i$的分压,$n_i$为组分$i$的物质的量,$n$为总物质的量)。
适用性更强的:
热力学第一定律:$\Delta U = Q - W$,其中 $\Delta U$ 是系统内能变化,$Q$ 是系统吸收的热量,$W$ 是系统对外做的功。适用于任何热力学系统的能量转换关系。
焓的定义式:$H = U + pV$,适用于任何处于平衡态的物质体系,用于描述体系的焓与内能、压强和体积的关系。
熵变定义式(克劳修斯不等式):$dS \geq \frac{\delta Q}{T}$(等号适用于可逆过程),$S$ 为熵,$\delta Q$ 为微小热量变化,$T$ 为热力学温度,描述任何系统的熵变与热量传递的关系。
物质的量相关基本换算公式 ○ $n = \frac{m}{M}$($n$ 为物质的量,$m$ 为质量,$M$ 为摩尔质量)。 ○ $n = \frac{N}{N_A}$($N$ 为微粒数,$N_A$ 为阿伏伽德罗常数),适用于各种物质的量计算。
反应热与键能关系:$\Delta H = \sum E_{\text{反应物键能}} - \sum E_{\text{生成物键能}}$,用于计算化学反应的焓变,适用于各种化学反应体系。
气体动力循环
勃莱顿循环
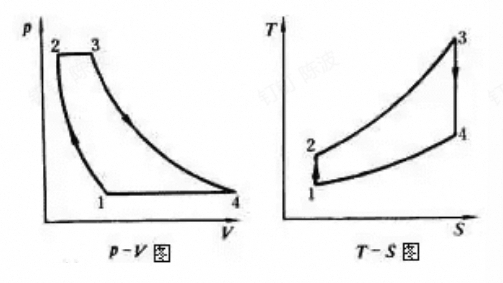
从1开始:
定熵压缩——定压加热——定熵膨胀——定压放热
- 引入循环增压比: $$ \pi=\frac{p_2}{p_1} $$
循环热效率完全取决于循环增压比,因为循环增压比确定了循环吸热与放热的平均温度之比
循环的净功量
$$ w_T=h_3-h_4=c_pT_3(1-\frac{T_4}{T_3})=c_pT_3(1-\frac{1}{\pi^{\frac{\gamma-1}{\gamma}}})\\w_C=h_2-h_1=c_pT_1(\frac{T_2}{T_1}-1)=c_pT_1(\pi^{\frac{\gamma-1}{\gamma}}-1) $$最后得到的循环的净功量为:
完全取决于循环的增压比,且存在最佳的增压比使其达到最大值
- 引入循环的增温比:$\tau=\frac{T_3}{T_1}$,则上述的最佳增压比可以由增温比得出
- T3上限收到材料的影响,T1下限受温度的影响
不可逆损失时的分析
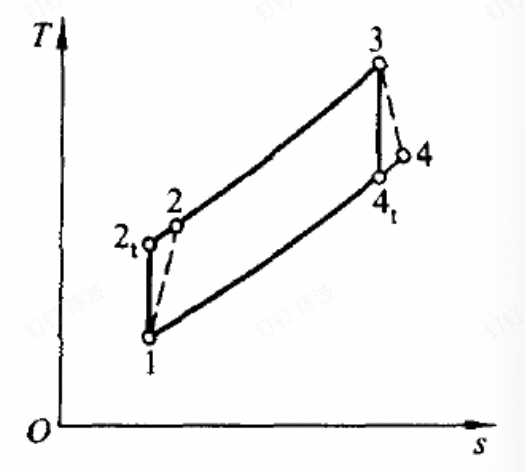
燃气轮机和压气机中存在摩擦损失;循环与热源和环境之间温差传热
- 燃气轮机的效率:
- 压气机的:
- 压气机出口的实际焓值:
- 循环的吸热量:
- 循环的净功量:
总的循环效率:
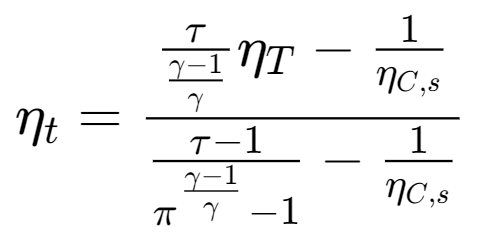
- 燃气轮机的摩擦损失使循环的功量减少,热效率降低
- 压气机的摩擦哦使循环功量和吸热量减少相同的数量,总的效果也使循环的热效率降低。
具有回热的循环
- 同时提高循环吸热的平均温度和降低放热的平均温度,提高循环的热效率
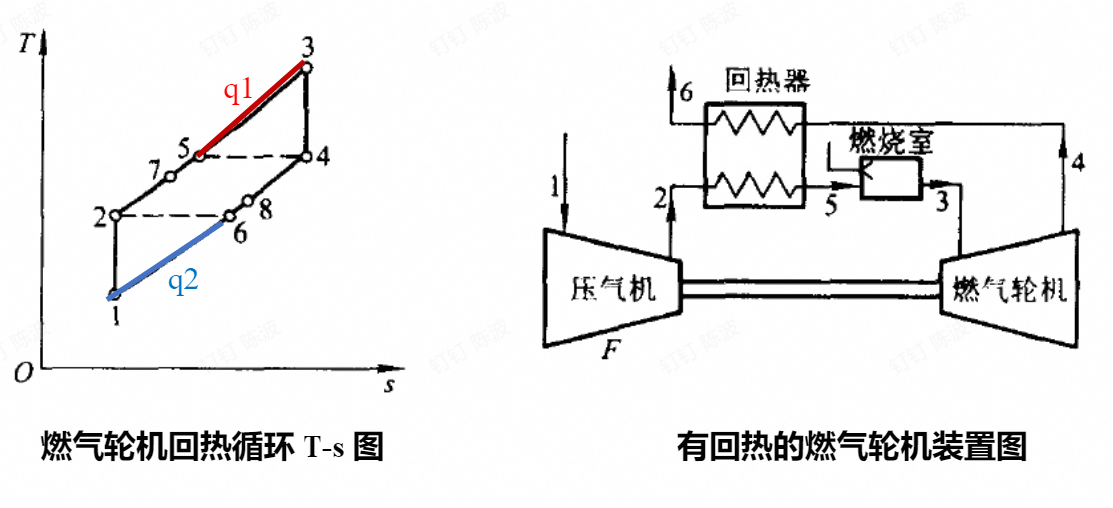
- 极限回热:回热器的燃气被冷却到的最低的温度T2,压缩空气被预热的最高的温度T4
- 回热度:
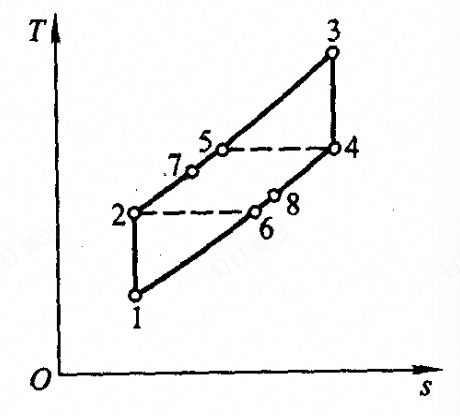
- 多级压缩(绝热压缩),中间冷却(等压冷却);多级膨胀,中间再热
- 当上述的分级趋向于无穷大时,循环与相同温度范围内的卡诺循环有相同的热效率,称为埃尔逊循环
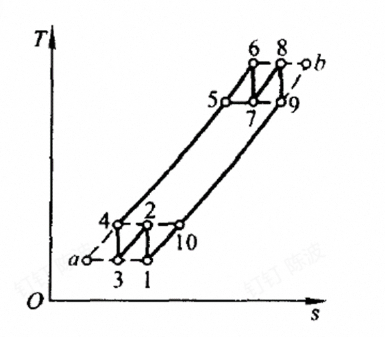
上下的锯齿状的就是多级的,每一个齿代表一级,无穷多时,将变成平行S轴的
内燃机的理想循环
- 工作循环组成:吸气、压缩、膨胀、排气
四冲程发动机
循环形式
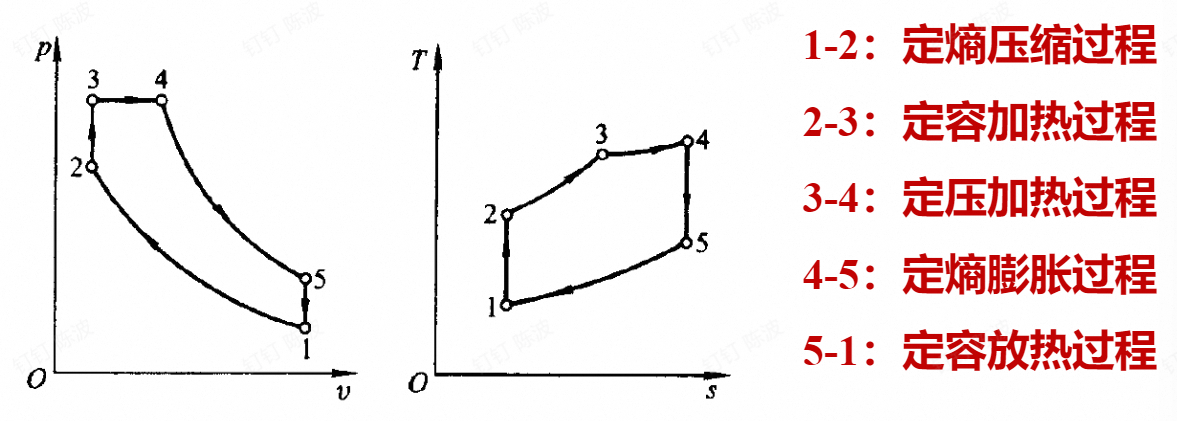
- 压燃式内燃机:为混合加热循环
- **点燃式内燃机:**定容加热循环
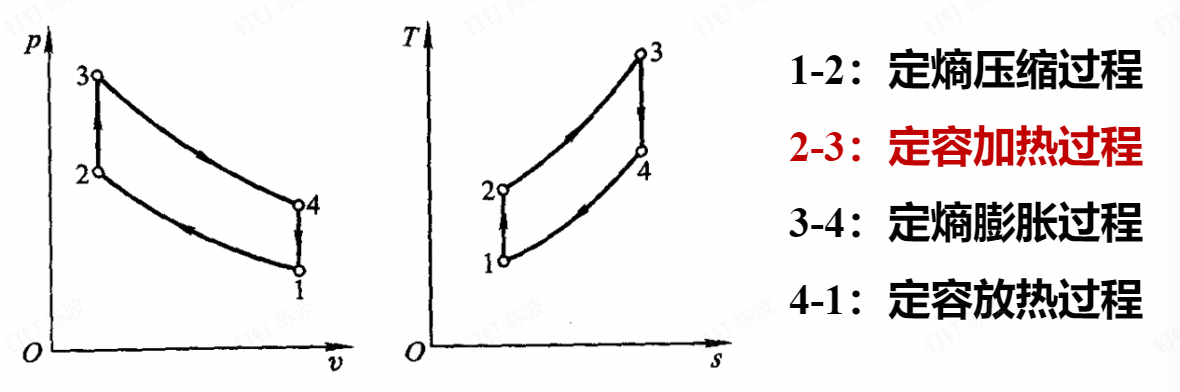
- 定压加热循环:
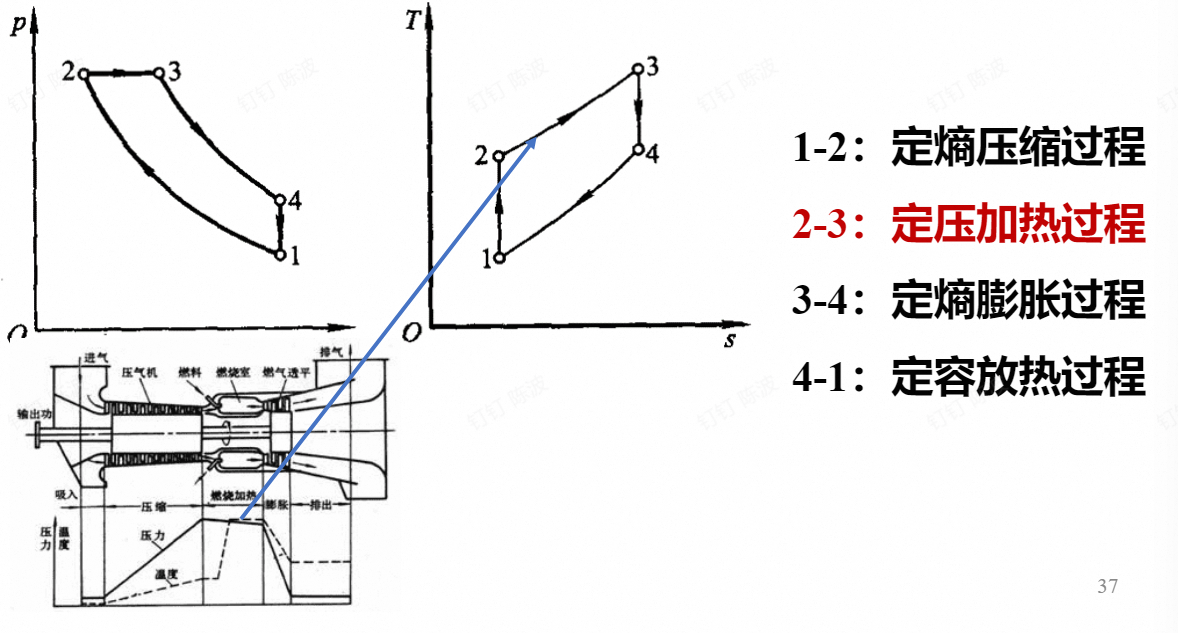
循环特性的参数:
压缩比:$\varepsilon = \frac {\nu _1}{\nu _2}$ 定容升压比:$\lambda = \frac {p_3}{p_2}$ 定压预胀比:$\rho=\frac{v_4}{v_3}$
对于上述的混合加热循环
$$ \begin{aligned}\boldsymbol{\eta}_{t}&=1-\frac{T_1(\lambda\rho^\gamma-1)}{T_1\varepsilon^{\gamma-1}(\lambda-1)+\gamma T_1\lambda\varepsilon^{\gamma-1}(\rho-1)}\\&=1-\frac{\lambda\rho^\gamma-1}{\varepsilon^{\gamma-1}[(\lambda-1)+\gamma\lambda(\rho-1)]}\end{aligned} $$由上式可知:混合加热循环的热效率随ε、λ的增大而增大,随 ρ 的减小而增大
-
定压预胀比为1时,为定容加热循环,其热效率为
$$ \eta_t=1-\frac{1}{\pi^{\frac{\gamma-1}{\gamma}}}\Longleftrightarrow\eta_{t,V}=1-\frac{1}{\varepsilon^{\gamma-1}} $$ -
当定容升压比λ=1,即为定压加热循环,其热效率为:
$$ \eta_{t,p}=1-\frac{1}{\varepsilon^{\gamma-1}}\frac{\rho^\gamma-1}{\gamma(\rho-1)} $$
三者的比较:
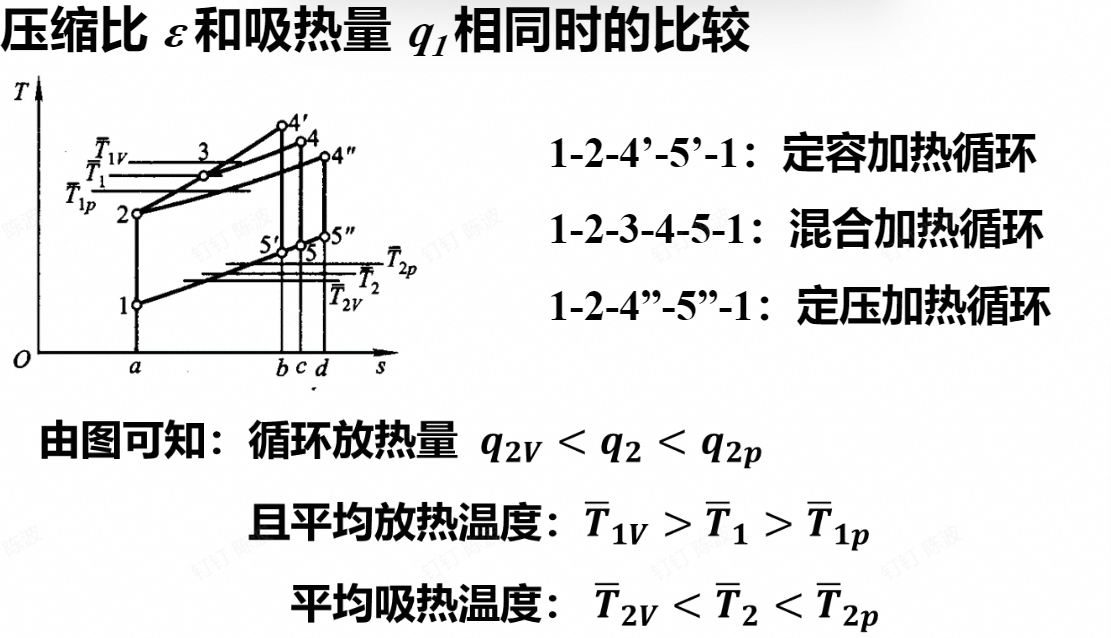
- 压缩比和吸热量相同时的
得到的效率的比较:
- 循环的最高压力和最高的温度相同时
效率的大小正好相反
总结比较
- 在压缩比相等时,定容加热具有较高的热效率
- 在其余所有情况下,当定压加热循环的压缩比大于定容加热循环时,定压加热循环具有较高的热效率
- 混合加热循环的热效率介于两者之间
喷气式发动机
做题:
-
这时候就是理想气体了,可以使用理想气体的公式进行计算
-
使用理想气体的公式进行计算时,注意不同类型的过程所使用的n的值是不同的
-
分清楚哪些是吸热、放热的过程;哪些是做功、对外做功的过程。吸放热的差值就是净功
制冷循环
相当于空调的循环,需要消耗有用功,将热从低温的物体移动到高温的物体
制冷机与热泵
- 以前学的各种热力循环都是为了获得对外做功
- 制冷循环的目的:将物体冷却,维持此低温状态
- 热机循环称为正循环,制冷循环称为逆循环
制冷系数:
其中的$q_1$为向外界放出的热量,其中的$q_2$为从低温处吸收的热量,满足$q_1=q_2+w$
$$ COP = \frac{得到的收益}{付出的代价} $$对于热泵:向热源输出热量与耗功之比,称为供暖系数ε’
对于制冷的装置,得到的收益为从低温的地方吸收的热量;对于制热的,得到的收益是对外界放出的热量
有如下的关系:
$$ \begin{aligned}&\varepsilon=\frac{q_{2}}{w}&&\varepsilon^{\prime}=\varepsilon+1\\\varepsilon^{\prime}=\frac{q_{1}}{w}=\frac{q_{2}+w}{w}=\frac{q_{2}}{w}+1&&COP_{HP}=COP_{R}+1\end{aligned} $$说明:
- $COP_{HP}$>1,这种情况下得到的好处比付出的代价高,说明热泵取暖比直接燃烧和电能经济性高。
- 制冷装置每小时从冷源吸取的热量叫做制冷装置的制冷量(kJ/h) 。每kg制冷剂每小时吸收热量叫做制冷剂的单位制冷率[kJ/(kg·h)]
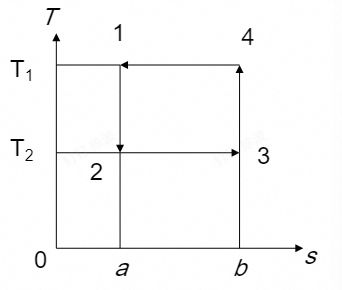
- 从一开始:
定熵膨胀——定温吸热——定熵压缩——定温放热
结果是将热从低温热源移向高温热源,称为逆卡诺循环(与卡诺热机的循环相反)
-
逆卡诺循环制冷系数:
$$ \varepsilon_{C}=\frac{q_{2}}{w}=\frac{T_{2}(s_{3}-s_{2})}{(T_{1}-T_{2})(s_{3}-s_{2})}=\frac{T_{2}}{T_{1}-T_{2}} $$
说明:
- 逆卡诺循环是在相同温度范围内工作的最有效的循环,即逆卡诺循环的制冷系数最大。
- 因为T1>T2,制冷系数$ε_C$恒为正值,且可以大于1, T1-T2愈小,ε愈大 。
空气制冷循环
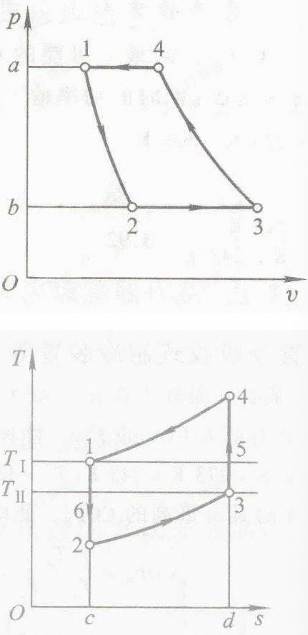
从1开始:
1-2:空气在膨胀机中定熵膨胀作功; 2-3:空气在冷藏室中定压吸热; 3-4:空气在压缩机中耗功定熵压缩; 4-1:空气在冷却器中定压放热。
实际上就是气体动力循环给逆过来了
循环消耗的净功量为:
空气制冷理想循环的制冷系数:
- 最后得到的制冷系数:
- 这个制冷系数看似与卡诺循环一致,但是,空气制冷循环中冷藏室所能达到的低温TⅡ = T3,而环境温度TI =T1,故在此温度范围内逆卡诺循环(如图中的1-6-3-5-1) 的制冷系数为:
- 将空气制冷循环的效率使用增压比表示:
可见,与增压比有关,增压比越小,制冷系数越大
但是,增压比小时,制冷能力小
空气制冷循环的缺点:
- 在定压的条件下进行,导致偏离卡诺循环,降低了经济性
- 空气的定压比热较小,制冷量也小
蒸气压缩制冷循环
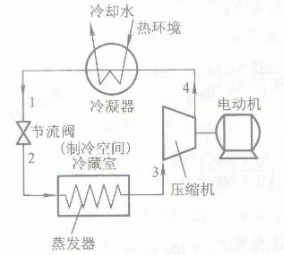
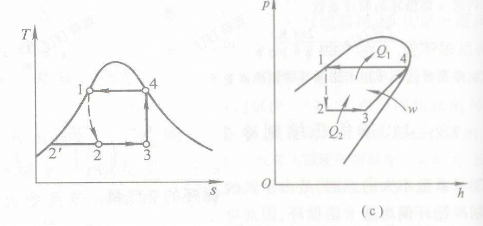
1-2:饱和液体(1)节流减压 熵增焓不变 2-3:定压吸热气化 干度增加 3-4:绝热升压压缩 干度增加 温度上升 4-1:冷却凝结成饱和液体
这里的1-2与蒸气动力循环不一致,剩下的还是非常一致的
实际能产生制冷的环节是2-3
4出口的可能是湿蒸汽、干饱和蒸汽或过热蒸汽
但是在实际的工程中往往采用干压缩: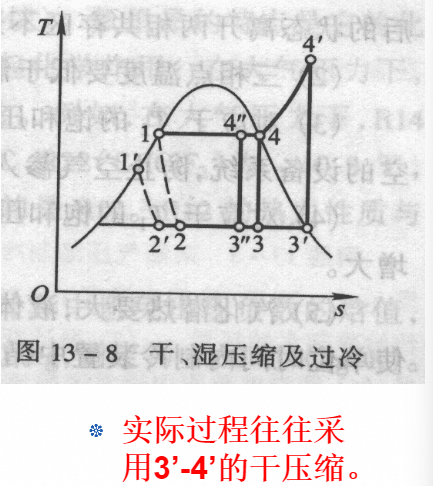
-
制冷系数:
$$ \varepsilon=\frac{q_2}{w}=\frac{h_3-h_2}{h_4-h_1} $$
优点说明:
- 蒸汽制冷循环与对应的拟卡诺循环更加接近,效率远高于空气制冷循环
- 可以满足较大单位的制冷需求
- 在0~-120°C范围内均可以采用蒸汽压缩制冷循环
- 上限温度T1取决与环境温度,下限温度T2取决于制冷对象(这里的上下限是吸放热过程的上下限,与压缩,膨胀之后的温度无关)
为实现蒸气压缩的制冷循环,对理想的制冷剂要求具有下列特性:
- 临界点温度必须高于制冷循环的上限温度T1,这样可使制冷剂被压缩后的状态离开两相共存区不远,而放热过程大部分可在两相区以定温过程进行。
- 三相点温度要低于制冷循环的下限温度T2。
- 对应于T2的饱和压力不宜太低,最好略高于大气压力,以免采用高真空的设备系统,防止空气渗入蒸发器,从而降低制冷能力。
蒸汽喷射制冷循环
- 用引射器来代替压缩机实现蒸汽的压缩,利用工作蒸汽进行加热,消耗热量来制冷。
- 蒸汽分为2路:制冷蒸汽,工作蒸汽
- 在引射器内高温高压的工作蒸汽首先经过喷管加速,压力下降后将制冷蒸汽吸入混合室,混合后进入扩压管,增压升温,然后进入冷凝器对环境放热,部分蒸汽经过节流阀进入制冷循环,部分经水泵压缩后进入锅炉重新吸热。
实际上是两个循环过程的嵌套
一个是相当于蒸气动力循环的过程,只不过定熵膨胀之后的气体与另一个气体混合又压缩(扩压管),再定压放热
一个是制冷循环,定压吸热后与另一个混合,再进行压缩和放热

使用热能利用系数进行表示效率:
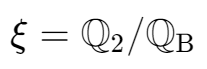
吸收式制冷
- 以高沸点物质作溶剂(吸收剂)、低沸点物质作溶质(制冷剂)组成的二元溶液,溶质的溶解度与温度有关。温度较低时,溶解度较大;温度较高时,溶解度较小。在制冷装置中利用溶液的这种特性,来取代对蒸汽的压缩过程,这样的制冷装置叫作吸收式制冷装置。
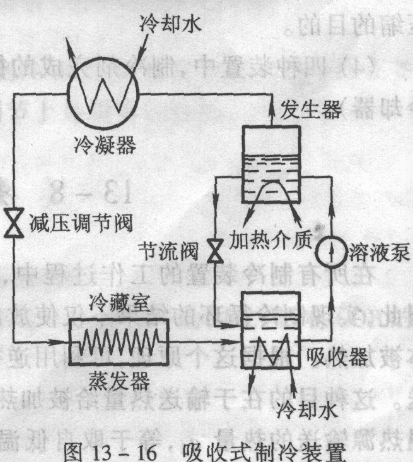
从冷藏室中取出的热量比送入氨蒸气发生器中的热量
热泵供热循环
- 热泵就其实质来看,和制冷装置完全一样,只是两者工作的温度范围不同,目的不同。
使用供热系数来衡量
$$ \mathrm{\varepsilon^{\prime}=q1~/w+(q2+w)~/w=\varepsilon+1} $$同样的原理
做题:
计算方式与之前没有什么大的差别,主要是计算效率的时候要分清楚计算的效率是什么
化学反应
概述
-
特点:非循环的过程
-
状态的确定多于两个参数
-
能量分析
热力学能U包括分子热运动的内动能、内位能和储存的化学能
热力学第一定理的应用
由于化学反应,与外界交换的功有体积功和非体积功
$$ \begin{aligned}&\delta Q=dU+(\delta W+\delta W_{_U})\\&\mathcal{Q}=\Delta U+(W+W_{_u})\end{aligned} $$-
定容的反应:
$$ \begin{aligned}&\delta W=pdV=d(pV)=0\\&-dU=\delta W_{u,V}-\delta Q\\&U_1-U_2=W_{u,V}-Q\end{aligned} $$ -
定压反应:
$$ \begin{aligned}&\delta W=pdV=d(pV)\\&W=p(V_{2}-V_{1})\\&-dH=\delta W_{u,p}-\delta Q\\&H_{1}-H_{2}=W_{u,p}-Q\end{aligned} $$
热效应
过程在定容或定压下不可逆进行,且过程中没有完成有用功,过程中放出/吸收的热量为过程的热效应
化学反应的功和热
-
燃烧热
1mol的物质全部氧化的热效应
-
生成热
- 由单质或元素化合生成1mol的化合物的热效应称为该化合物的生成热
- 常取标准大气压,t=25℃的热效应为标准热效应
-
定容热效应:
$$ Q_v=U_2-U_1 $$ -
定压热效应:
$$ Q_{_p}=H_{_2}-H_{_1} $$ -
上述两个热效应的关系:
$$ \begin{aligned}&Q_P-Q_V=(H_2-H_1)-(U_2-U_1)=p(V_2-V_1)\\&Q_P=Q_V+pV_m\Delta n=Q_V+RT\Delta n\end{aligned} $$
赫斯定律
- 表述:化学反应的热效率与所经历的中间状态无关,只与物质的初始、终了状态有关
所以,利用热效应是状态量,可以间接测量一些难以直接测量的反应的热效应
基尔霍夫定律
温度对热效应的影响显著,压力只有在很高的时候才表现出来
反应在任意的T温度下进行,热效应为
$$ \int_{Q^{0}}^{Q_{*}}\mathrm{d}Q_{*}=\int_{T_{0}}^{T}\left(\sum_{j}n_{j}C_{m,j}\right)\mathrm{d}T-\int_{T_{0}}^{T}\left(\sum_{i}n_{i}C_{m,i}\right)\mathrm{d}T $$或者是
$$ Q_{*}=Q^{0}+\int_{T_{0}}^{T}\left(\sum_{j}n_{j}C_{m,j}\right)\mathrm{d}T-\int_{T_{0}}^{T}\left(\sum_{i}n_{i}C_{m,i}\right)\mathrm{d}T $$所以,根据基尔霍夫定理。反应在某个温度下的反应热
$$ \Delta H=\Delta H^{0}+\Delta H_{re}+\Delta H_{pr} $$其中的第一项为某一特定温度下的热效应
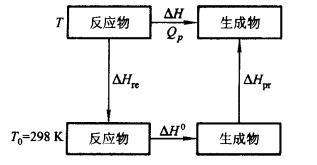
如图所示的变化过程
- 反应物变为特定温度下的反应物
- 特定温度下的反应物生成生成物
- 生成物再变回那一温度下的生成物
理论燃烧温度
-
对于定压的过程
$$ -\Delta H_{\mathrm{b}}^{0}=\Delta H_{\mathrm{pr}}=\int_{T_{0}}^{T_{1}}C_{p,m,\mathrm{pr}}\mathrm{d}T=\int_{T_{0}}^{T_{1}}\sum_{j,pr}n_{j}C_{p,m,j}\mathrm{d}T $$ -
定容的过程
$$ -\Delta U_{\mathrm{b}}^{0}=\Delta U_{\mathrm{pr}}=\int_{T_{0}}^{T_{,}}C_{V,\mathrm{m.pr}}\mathrm{d}T=\int_{T_{0}}^{T_{,}}\sum_{j,\mathrm{pr}}n_{j}C_{V,m,j}\mathrm{d}T $$
化学反应方向的判据
使用$\Delta G$来判断,小于0时可以自发进行(正向进行)
反应的最大功
$$ W_{u.V.max}=F_{1}-F_{2} $$写为概括性的公式为
$$ W_{\mathrm{u,max}}=-Q_{x}+T\left(\frac{\partial W_{\mathrm{u,max}}}{\partial T}\right) $$规定在1大气压、25摄氏度时的由稳定的单质生成1mol的化合物时自由焓的变化为该化合物的标准自由生成焓。(稳定的单质会元素的标准自由生成焓为0)
公式
$$ \Delta G^{0}=\sum_{i}\left(n_{j}\Delta G_{i,j}^{0}\right)_{\mathrm{pr}}-\sum_{i}\left(n_{i}\Delta G_{i,i}^{0}\right)_{\mathrm{re}} $$任何反应的自由焓的变化量可以由反应物和生成物的标准自由生成焓计算:
反应的平衡
反应的关系式子有
$$ \Delta G=\Delta G^{0}+RT\mathrm{ln}\frac{P_{\mathrm{C}}^{c}P_{\mathrm{E}}^{e}}{p_{\mathrm{A}}^{a}p_{\mathrm{B}}^{b}} $$对于定温定压的反应,在平衡时有:(这里的压强是分压)
$$ \begin{aligned}&\Delta G=0\\&p_{\mathrm{A}}=p_{\mathrm{A,e}}\\&p_{\mathrm{B}}=p_{\mathrm{B,e}}\\&p_{\mathrm{C}}=p_{\mathrm{C,e}}\\&\mathrm{PE}=p_{\mathbf{E},\mathbf{e}}\end{aligned} $$所以带入上述的式子可以得到
$$ \Delta G^{0}=-RT\mathrm{ln}\frac{P_{\mathrm{C,e}}^{c}P_{\mathrm{E,e}}^{c}}{p_{\mathrm{A,e}}^{a}P_{\mathrm{B,e}}^{b}} $$$$ K_{p}=\frac{p_{\mathrm{C,e}}^{c}P_{\mathrm{E,e}}^{e}}{p_{\mathrm{A,e}}^{a}P_{\mathrm{B,e}}^{b}} $$这个式子就是反应的化学平衡常数
若是使用反应物或是生成物的浓度表示平衡常数
$$ \begin{aligned}K_{p}&=\frac{(\left[\mathbf{C}_{\mathrm{e}}\right]RT)^{c}(\left[\mathbf{E}_{\mathrm{e}}\right]RT)^{c}}{(\left[\mathbf{A}_{\mathrm{e}}\right]RT)^{a}(\left[\mathbf{B}_{\mathrm{e}}\right]RT)^{b}}\\&=\frac{[\mathbf{C_{e}}]^{c}[\mathbf{E_{e}}]^{c}}{[\mathbf{A_{e}}]^{a}[\mathbf{B_{e}}]^{b}}(RT)^{[(c+\epsilon)-(a+b)]}\\&=\frac{[\mathbf{C_{e}}]^{c}[\mathbf{E_{e}}]^{c}}{[\mathbf{A_{e}}]^{a}[\mathbf{B_{e}}]^{b}}(RT)^{\Delta n}\end{aligned} $$所以,得到的浓度表示的平衡常数为
$$ K_{\mathrm{c}}=\frac{[\mathrm{C}_{\mathrm{e}}]^{c}[\mathrm{E}_{\mathrm{e}}]^{c}}{[\mathrm{A}_{\mathrm{e}}]^{a}[\mathrm{B}_{\mathrm{e}}]^{b}} $$两者之间的关系是:(n为反应前后的物质的量之差)
$$ K_{_p}=K_{_c}(RT)^{\Delta n} $$与最大的有用功之间的关系
$$ W_{_{u,max}}=RT\left(\ln K_{_p}-\ln\frac{p_{_C}^{c}p_{_E}^{\epsilon}}{p_{_A}^{a}p_{_B}^{b}}\right) $$$$ W_{_{u,max}}=RT\left(\ln K_{_{c}}-\ln\frac{\left[\mathbf{C}\right]^{c}\left[\mathbf{E}\right]^{c}}{\left[\mathbf{A}\right]^{a}\left[\mathbf{B}\right]^{b}}\right) $$热力学第三定律
$$ S_{1}=\int_{T=0}^{T}\frac{C_{1}}{T}\mathrm{d}T+S_{1.0}\\S_{2}=\int_{T=0}^{T}\frac{C_{2}}{T}\mathrm{d}T+S_{2,0} $$有如下的结论:
- 在绝对零度的条件下凝聚态物体的熵为0
- 在绝对零度的条件下凝聚物体的热容为0
做题
计算热效应的时候,在等温等压的条件下就使用焓变(使用生成焓作差)
计算最大的功的时候,使用自由焓变
在计算分压的时候用的压强为1,2atm(即相对于大气压强的次数)
复习
todo
- 看一下所有的作业题
- 做一下所有的历年卷子
- 熵增的那一部分
- 还有之前的那个温度的那个4状态
- 还有就是使用Rg的那个公式是哪个来着
- 湿空气的计算、图像这些
热力学第一定理
理想气体的内能只与温度、物质的量以及气体的种类有关
在我们考虑的过程中,一般只考虑理想气体的温度
所以,热力学能等于从外界吸收的热量和外界对物体做的功的总和(实际上就是能量守恒的含义)
重要的是热力学能对应的是体积功
焓对应的是技术功
好像是除了pv=nRT(还有通过这个衍生出来的公式)是只适用于气体,其他的所有都是适用于所有的吧
记住u,h的全微分的方程式子就可以推导出一阶的关系式(将参数使用微分比值的形式表示)
二阶的里面记住含有s的式子
注意,在湿蒸气的部分,当是左边的液态水的状态时,不能使用理想气体的公式
注意相变过程的特殊性:温度不变、压强不变,但是热力学能还有焓值是会变化的。(这个过程是不能使用针对理想气体的公式的,只能查表)
所以,热量只有在体积或者是压强不变的情况下,才可以只写成比热乘以温度变化的形式,而焓值和热力学能对于理想气体都可以那么写
理想气体的功也能使用温度的变化表示,则最后的热量也可以使用温度×比热表示,只不过这个比热是会变化的比热。
在定熵的流动过程中,要记得速度有两个,一个是对应温度下的声速,一个是气体的流速。声速与温度有直接的换算,流速与焓有能量守恒的关系
公式的适用性
-
适用于理想的气体的:
- 焓、热力学能、熵=固定的比热×温度变化的公式(熵可能还带上了压强)
- pv=nRT
-
使用与所有的热力学系统的(是能用在下面3中的特殊情况的)
-
热力学第一定律,就是热量、功、焓、热力学能这些关系等式
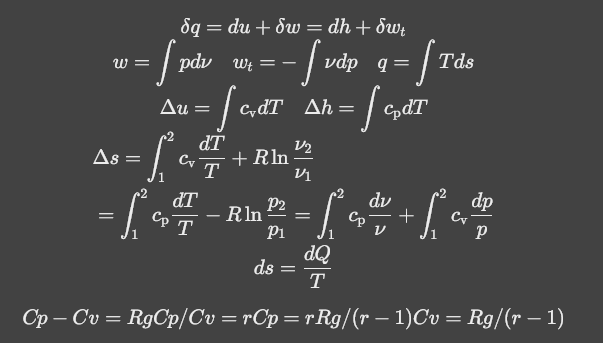
-
与功有关的那些——$W=pdv$
-
$S=\frac{Q}{T}$也就是热力学第二定律
-
还有在热力学基本关系中学习的那些非常复杂的公式
-
-
还有一些特殊的:
- 热量=固定(等容、等压)比热×温度变化(只有在等压、等容的条件下适用,实际上也就是热量、功、能的关系的推导),但是可以使用非固定的(多变比热$Cn$)乘以温度变化
- 对于液态的、相变过程的h、u这些,只能查表进行计算